题目内容
13.二甲苯的同分异构体有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
分析 根据2个甲基可以是邻位、间位、对位三种情况来解答.
解答 解:二甲苯有邻二甲苯、间二甲苯、对二甲苯三种同分异构体,故选C.
点评 本题主要考查同分异构体的书写,难度较小,注意取代基的位置即可.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
10.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴.
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5.

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5.
4.加碘食盐中加入的碘酸钾是一种白色结晶粉末,常温下性质稳定,加热至560℃开始分解.在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应.工业生产碘酸钾的流程如下:
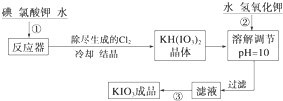
(1)已知步骤①反应器发生的反应中,单质碘和氯酸钾的物质的量之比为6:11,则反应器中发生反应的化学方程式为6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑.
(2)步骤②中调节pH=10的目的是使KH(IO3)2转化为KIO3.
参照碘酸钾的溶解度:
操作③的方法是蒸发结晶.
(3)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应,然后用四氯化碳检验生成的碘单质时,甲应观察到的明显现象有液体分层,下层液体呈现紫红色.
学生乙对纯净的NaCl进行了如下实验:取1g纯净的NaCl,加3mL水配成溶液,然后滴入5滴淀粉溶液和1mL 0.1mol•L-1 KI溶液,振荡,溶液无变化,然后再滴入1滴1mol•L-1的H2SO4,振荡,一段时间后溶液变浅蓝色.请推测实验中产生蓝色现象的可能原因,用离子方程式表示4I-+4H++O2═2I2+2H2O.
(4)学生丙查阅有关食品碘强化剂的资料后知道,碘酸钙也是一种允许使用的食品碘强化剂,它是一种白色结晶或结晶性粉末,难溶于水和乙醇.丙同学在氯化钙溶液中加入理论量的碘酸钾溶液,反应生成的沉淀经水洗后,室温下干燥得碘酸钙晶体,加热至160~540℃变成无水物,此时固体质量为原晶体质量的78.3%,写出制备碘酸钙晶体的离子方程式:Ca2++2IO${\;}_{3}^{-}$+6H2O═Ca(IO3)2•6H2O;检验沉淀已经洗涤干净的方法是在最后一次洗涤液中加入硝酸银溶液,若无白色沉淀说明已经洗涤干净.

(1)已知步骤①反应器发生的反应中,单质碘和氯酸钾的物质的量之比为6:11,则反应器中发生反应的化学方程式为6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑.
(2)步骤②中调节pH=10的目的是使KH(IO3)2转化为KIO3.
参照碘酸钾的溶解度:
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3 g/100g H2O | 8.08 | 12.6 | 18.3 | 24.8 |
(3)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应,然后用四氯化碳检验生成的碘单质时,甲应观察到的明显现象有液体分层,下层液体呈现紫红色.
学生乙对纯净的NaCl进行了如下实验:取1g纯净的NaCl,加3mL水配成溶液,然后滴入5滴淀粉溶液和1mL 0.1mol•L-1 KI溶液,振荡,溶液无变化,然后再滴入1滴1mol•L-1的H2SO4,振荡,一段时间后溶液变浅蓝色.请推测实验中产生蓝色现象的可能原因,用离子方程式表示4I-+4H++O2═2I2+2H2O.
(4)学生丙查阅有关食品碘强化剂的资料后知道,碘酸钙也是一种允许使用的食品碘强化剂,它是一种白色结晶或结晶性粉末,难溶于水和乙醇.丙同学在氯化钙溶液中加入理论量的碘酸钾溶液,反应生成的沉淀经水洗后,室温下干燥得碘酸钙晶体,加热至160~540℃变成无水物,此时固体质量为原晶体质量的78.3%,写出制备碘酸钙晶体的离子方程式:Ca2++2IO${\;}_{3}^{-}$+6H2O═Ca(IO3)2•6H2O;检验沉淀已经洗涤干净的方法是在最后一次洗涤液中加入硝酸银溶液,若无白色沉淀说明已经洗涤干净.
1.下列物质只表示一种纯净物的是( )
| A. | C4H10 | B. | C2H4Cl2 | C. | CH2Cl2 | D. | 聚乙烯 |
8.下列性质的递变中,正确的是( )
| A. | N、P、Mg的原子半径依次减小 | B. | LiOH、KOH、CsOH的碱性依次减弱 | ||
| C. | HF、H2O、SiH4的稳定性依次减弱 | D. | HCl、HBr、HI的酸性依次减弱 |
5.铬(Cr)是重要的金属元素.
不同铬的化合物或离子的水溶液的颜色如下:
含铬元素的化合物可以发生如下一系列变化:

(1)反应①的还原剂是Zn,反应②的离子方程式为Cr3++3OH-═Cr(OH)3↓.
(2)在K2Cr2O7橙色溶液中逐滴加入NaOH溶液,溶液逐渐变为黄色,该反应的离子方程式为Cr2O72-+2OH-═2CrO42-+H2O.
(3)将KCl和CrCl3两种固体混合物共熔制得化合物X,将0.0035mol X中的Cr元素全部氧化成Cr2O72-,得到的Cr2O72-与过量的KI反应生成0.0105mol I2,反应的离子方程式为Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O;
另取0.0035mol X溶于水中,当加入0.0315mol AgNO3时,恰好沉淀完全.则表示X组成的化学式为K3Cr2Cl9.
不同铬的化合物或离子的水溶液的颜色如下:
| 离子或化合物 | Cr2O72- | Cr(OH)3 | Cr(OH)4- | Cr3+ | CrO42- |
| 颜色 | 橙色 | 灰蓝色 | 绿色 | 绿色 | 黄色 |

(1)反应①的还原剂是Zn,反应②的离子方程式为Cr3++3OH-═Cr(OH)3↓.
(2)在K2Cr2O7橙色溶液中逐滴加入NaOH溶液,溶液逐渐变为黄色,该反应的离子方程式为Cr2O72-+2OH-═2CrO42-+H2O.
(3)将KCl和CrCl3两种固体混合物共熔制得化合物X,将0.0035mol X中的Cr元素全部氧化成Cr2O72-,得到的Cr2O72-与过量的KI反应生成0.0105mol I2,反应的离子方程式为Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O;
另取0.0035mol X溶于水中,当加入0.0315mol AgNO3时,恰好沉淀完全.则表示X组成的化学式为K3Cr2Cl9.
2.下列有关实验操作的说法正确的是( )
| A. | 用10mL量筒量取8.10mL稀盐酸 | |
| B. | 用pH计测得某溶液的pH为2.2 | |
| C. | 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 | |
| D. | 可用25mL碱式滴定管量取20.00mL KMnO4溶液 |
3. 某实验小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某实验小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
Ⅰ.配制0.50mol•L-1 NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g.
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母):abe.
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
(1)写出该反应中和热的热化学方程式:(中和热为57.3kJ•mol-1)$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①上表中的温度差平均值为4.0℃
②近似认为0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液的密度都是1g•cm-3,中和后生成溶液的比热容c=“4.18“J•(g•℃)-1.则中和热△H=-53.5kJ/mol(取小数点后一位).
③上述实验数值结果与57.3kJ•mol-1有偏差,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
④实验中改用60mL0.5mol/L盐酸跟50mL0.55moi/L氢氧化钠进行反应,与上述实验相比,所放出的热量不相等(填相等或不相等,下同),所求的中和热相等,简述理由中和热是指酸跟碱发生中和反应生成lmolH2O所放出的热量,它与酸、碱的用量无关.
 某实验小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某实验小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.Ⅰ.配制0.50mol•L-1 NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g.
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母):abe.
| 名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
(1)写出该反应中和热的热化学方程式:(中和热为57.3kJ•mol-1)$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.6 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液的密度都是1g•cm-3,中和后生成溶液的比热容c=“4.18“J•(g•℃)-1.则中和热△H=-53.5kJ/mol(取小数点后一位).
③上述实验数值结果与57.3kJ•mol-1有偏差,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
④实验中改用60mL0.5mol/L盐酸跟50mL0.55moi/L氢氧化钠进行反应,与上述实验相比,所放出的热量不相等(填相等或不相等,下同),所求的中和热相等,简述理由中和热是指酸跟碱发生中和反应生成lmolH2O所放出的热量,它与酸、碱的用量无关.
 .
. ),它能与Fe2+形成红色配合物(如右图2),
),它能与Fe2+形成红色配合物(如右图2),