题目内容
15.新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水.工业上常通过以下两步反应制备K2FeO4:①2FeCl3+10NaOH+3NaClO═2Na2FeO4+9NaCl+5H2O
②Na2FeO4+2KOH═K2FeO4+2NaOH
下列说法不正确的是( )
| A. | 反应①为氧化还原反应,反应②为复分解反应 | |
| B. | 反应①中物质氧化性的强弱顺序是:NaClO>Na2FeO4>FeCl3 | |
| C. | 若有2mol FeCl3 发生反应,转移电子的物质的量为 6mol | |
| D. | Na2FeO4能杀菌消毒是因为溶于水产生Fe(OH)3胶体 |
分析 A、有电子转移的化学反应是氧化还原反应,其特征是有元素化合价变化;
B、根据氧化剂的氧化性强于氧化产物的氧化性,强于还原剂的氧化性;
C、根据化合价变化计算转移电子数;
D、Na2FeO4能杀菌消毒是因为Na2FeO具有极强的氧化性.
解答 解:A、①中铁元素的化合价由+3价变为+6价,氯元素的化合价由+1价变为-1价,所以是氧化还原反应;
②中各元素的化合价不发生变化,所以不是氧化还原反应,该反应是碱和盐反应生成另外的碱和盐,属于复分解反应,故A正确;
B、根据氧化剂的氧化性强于氧化产物的氧化性,强于还原剂的氧化性,所以氧化性:NaClO>Na2FeO4>FeCl3,故B正确;
C、若有2 mol FeCl3 发生反应,转移电子的物质的量=2mol(6-3)=6mol,故C正确;
D、Na2FeO4能杀菌消毒是因为Na2FeO具有极强的氧化性,而不是溶于水产生Fe(OH)3胶体,故D错误;
故选D.
点评 本题考查氧化还原反应,明确元素化合价是解本题关键,会根据化合价变化来分析解答,难度不大.

练习册系列答案
相关题目
5.有两种气态烷烃的混合物,在标准状况下,其密度为1.16g/L,则关于此混合物组成的说法正确的是( )
| A. | 一定是甲烷与乙烷的混合物 | B. | 可能是甲烷与丙烷的混合物 | ||
| C. | 一定含有乙烷 | D. | 可能是甲烷与己烷的混合物 |
6.下列说法错误的是( )
| A. | 从1L1mol•L-1的NaCl溶液中取出10mL,其浓度仍为1mol•L-1 | |
| B. | 配制0.5L1mol•L-1的盐酸,需要氯化氢气体11.2L(标准状况) | |
| C. | 将40gNaOH溶于1L水中,所得溶液的物质的量浓度为1mol/L | |
| D. | 0.5L2mol•L-1BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023 |
10.下列反应的离子方程式书写正确的是( )
| A. | 小苏打和盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 铁粉与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与明矾溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 氧化铝溶于强碱:Al2O3+2OH-═2AlO2-+H2O |
20.下列物质互为同位素的一组是( )
| A. | 35 Cl和37Cl | B. | CH3CH2OH和CH3OCH3 | ||
| C. | O2和O3 | D. | H2O和H2O2 |
7.2015年12月12日,《联合国气候变化框架公约》近200个缔约方一致同意通过《巴黎协定》.指出各国应提高力度、加强国际合作,实现全球应对气候变化长期目标.下列做法与社会可持续发展理念相违背的是( )
| A. | 改进汽车尾气净化技术,减少大气污染物的排放 | |
| B. | 开发利用可再生能源,减少化石燃料的使用 | |
| C. | 研发可降解高分子材料,减少“白色污染冶 | |
| D. | 过度开采矿物资源,促进地方经济发展 |
4.下列关于 的说法中正确的是( )
的说法中正确的是( )
 的说法中正确的是( )
的说法中正确的是( )| A. | 所有碳原子都在同一平面上 | |
| B. | 最多只可能有9个碳原子在同一平面上 | |
| C. | 只可能有5个碳原子在同一直线上 | |
| D. | 可能有6个碳原子在同一直线上 |
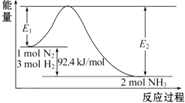 工业合成氨反应的能量变化如图所示.
工业合成氨反应的能量变化如图所示.