题目内容
 有可逆反应Fe(s)+CO2(g)?FeO(s)+CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2.
有可逆反应Fe(s)+CO2(g)?FeO(s)+CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2.(1)能判断该反应达到平衡状态的依据是
A.容器内压强不变 B.c(CO)不变 C.v正(CO2)=v逆(CO) D.c(CO2)=c(CO)
(2)该反应的正反应是
(3)写出该反应的平衡常数表达式
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”).
①升高温度
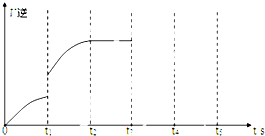
(5)该反应的逆反应速率随时间变化的关系如图:
①从图中看到,反应在t2时达平衡,在t1时改变了某种条件,改变的条件可能是
A. 升温 B.增大CO2浓度C. 增大压强 D.增加Fe的物质的量.
考点:用化学平衡常数进行计算,化学平衡的影响因素,化学平衡状态的判断
专题:
分析:(1)化学平衡的特征是正逆反应速率相等,反应混合物中各组分的百分含量保持不变,然后根据具体的化学方程式逐一判断;
(2)根据温度变化对化学平衡常数的影响判断该反应是吸热还是放热;
(3)根据化学平衡常数的表达式及反应方程式写出该反应的平衡常数表达式;根据二氧化碳和一氧化碳的浓度计算出平衡常数;
(4)根据影响化学平衡常数的因素进行分析;
(5)①根据右图t1时刻,反应速率突然增大以及逆反应速率后来逐渐增大最后不变.
(2)根据温度变化对化学平衡常数的影响判断该反应是吸热还是放热;
(3)根据化学平衡常数的表达式及反应方程式写出该反应的平衡常数表达式;根据二氧化碳和一氧化碳的浓度计算出平衡常数;
(4)根据影响化学平衡常数的因素进行分析;
(5)①根据右图t1时刻,反应速率突然增大以及逆反应速率后来逐渐增大最后不变.
解答:
解:(1)A、因反应前后气体的体积相同,容器内压强不能作为达到平衡的标志,故A错误;
B、c(CO)不变,说明正逆反应速率相等,达到了平衡状态,故B正确;
C、v正(CO2)=v逆(CO ),正逆反应速率相等,各组分的浓度不再变化,达到了平衡状态,故C正确;
D、c(CO2)=c(CO),不能判断不能判断正逆反应速率相等,无法判断是否达到平衡状态,故D错误;
故选:BC;
(2)在温度938K时,平衡常数K=1.5,在1173K时,K=2.2,温度升高,化学平衡常数增大,说明该反应为吸热反应,故答案为:吸热;
(3)由可逆反应Fe(s)+CO2(g)?FeO(s)+CO(g),该反应的平衡常数表达式为:K=
;CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0mol/L,则反应消耗的二氧化碳的浓度为:1.0mol/L,达到平衡时二氧化碳浓度为1.0mol/L,则该温度下的平衡常数为:K=
=
=1.0,
故答案为:
;1.0;
(4)①该反应为吸热反应,升高温度,平衡向着正向移动,二氧化碳的体积分数减小,故答案为:减小;
②再通入CO,由于压强不影响化学平衡,达到平衡时各组分的含量不变,故答案为:不变;
(5)A.升温,正、逆反应速率突然增大,随着反应的进行,生成物的浓度增大,逆反应速率增大,最后不变,故A正确;
B.增大CO2的浓度,正反应速率突然增大,逆反应速率瞬间不变,故B错误;
C.反应前后气体体积不变,增大压强 平衡不动,故C错误;
D、固体不影响化学反应速率和平衡状态,增加Fe的物质的量不能改变化学平衡和反应速率,故D错误;
故选:A.
B、c(CO)不变,说明正逆反应速率相等,达到了平衡状态,故B正确;
C、v正(CO2)=v逆(CO ),正逆反应速率相等,各组分的浓度不再变化,达到了平衡状态,故C正确;
D、c(CO2)=c(CO),不能判断不能判断正逆反应速率相等,无法判断是否达到平衡状态,故D错误;
故选:BC;
(2)在温度938K时,平衡常数K=1.5,在1173K时,K=2.2,温度升高,化学平衡常数增大,说明该反应为吸热反应,故答案为:吸热;
(3)由可逆反应Fe(s)+CO2(g)?FeO(s)+CO(g),该反应的平衡常数表达式为:K=
| c(CO) |
| c(CO2) |
| c(CO) |
| c(CO2) |
| 1.0mol/L |
| 1.0mol/L |
故答案为:
| c(CO) |
| c(CO2) |
(4)①该反应为吸热反应,升高温度,平衡向着正向移动,二氧化碳的体积分数减小,故答案为:减小;
②再通入CO,由于压强不影响化学平衡,达到平衡时各组分的含量不变,故答案为:不变;
(5)A.升温,正、逆反应速率突然增大,随着反应的进行,生成物的浓度增大,逆反应速率增大,最后不变,故A正确;
B.增大CO2的浓度,正反应速率突然增大,逆反应速率瞬间不变,故B错误;
C.反应前后气体体积不变,增大压强 平衡不动,故C错误;
D、固体不影响化学反应速率和平衡状态,增加Fe的物质的量不能改变化学平衡和反应速率,故D错误;
故选:A.
点评:本题考查了化学平衡状态的判断、化学平衡的影响因素等知识,题目难度中等,本题是一道化学反应速率与平衡的综合题,注意掌握平衡常数的含义、化学平衡状态的判断方法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列各组混合物无论以何种比例混合,只要总的物质的量一定,完全燃烧时消耗氧气的量是定值的是( )
| A、CH2O、C2H4O2、C6H12O6 |
| B、C6H6、C5H12、C7H6O2 |
| C、CH2=CH2、C2H5OH、HOCH2CH2COOH |
| D、H2、CO CH3OH |
一定条件下,一个密闭容器中;加入1molN2和3moH2发生N2+3H2?2NH3 反应,则下列叙述正确的是( )
| A、若速率V(N2):V(H2):V(NH3)=1:3:2,则该反应反应达到了平衡状态 |
| B、反应开始时,若3molH-H键断裂,则有2mol N-H 键生成 |
| C、改变条件可以改变该反应限度,会使反应物完全反应 |
| D、当反应混合物各组分的物质的量浓度不再改变,该反应达到平衡 |
对于金属冶炼的工业方法.下列有关说法中正确的是( )
| A、可用电解饱和的MgCl2溶液的方法获得金属镁 |
| B、电解熔融Al2O3方法冶炼金属铝时,用铁做阳极 |
| C、电解熔融Al2O3方法冶炼金属铝时,同时要加入冰晶石作熔剂 |
| D、工业上常采用活泼金属还原法冶炼金属银 |
根据原电池的有关知识,下列反应不能用于原电池的是( )
A、2H2+O2
| ||||
B、NaOH+HCl
| ||||
| C、2CH3OH+3O2═2CO2+4H2O | ||||
| D、Zn+2HCl═ZnCl2+H2↑ |
铅蓄电池的两极分别为Pb、PbO2,电解质溶液为H2SO4,工作时的反应为Pb+PbO2+2H2SO4═2PbSO4+2H2O,下列结论正确的是( )
| A、Pb为正极被氧化 |
| B、溶液的pH不断减小 |
| C、SO42-只向PbO2处移动 |
| D、电解质溶液pH不断增大 |
下列物质的沸点变化顺序正确的是 ( )
| A、CH4<SiH4<GeH4<SnH4 |
| B、NH3<PH3<AsH3<SbH3 |
| C、H2O>H2S>H2Se>H2Te |
| D、HF>HCl>HBr>Hl |
下列氢化物中最稳定的是( )
| A、CH4 |
| B、SiH4 |
| C、HCl |
| D、HF |
 如图为持续电解含一定CaCl2水溶液的装置(以铂为电极),A为电流表.电解一段时间t1后,将CO2持续通入电解液中.
如图为持续电解含一定CaCl2水溶液的装置(以铂为电极),A为电流表.电解一段时间t1后,将CO2持续通入电解液中.