题目内容
已知H+(aq)+OH-(aq)=H2O (l);△H=-57.3KJ/mol.则下列热化学方程式正确的是( )
| A、CH3COOH(aq)+NaOH(aq)=CH3COONa (aq)+H2O(l);△H=-57.3KJ/mol |
| B、H2SO4(aq)+Ba(OH)2(aq)=BaSO4 (s)+2 H2O(l);△H=-114.6KJ/mol |
| C、HCl(aq)+NaOH(s)=NaCl (aq)+H2O(l);△H=-57.3KJ/mol |
| D、HI(aq)+KOH(aq)=KI(aq)+H2O(l);△H=-57.3KJ/mol |
考点:热化学方程式
专题:化学反应中的能量变化
分析:反应热为57.3kJ/mol是强酸和强碱的稀溶液反应生成1mol水放出的热量,依据概念分析判断.
解答:
解:A、醋酸是弱酸,不完全电离,电离是吸热过程,所以△H>-57.3KJ/mol,故A错误;
B、H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)反应应该是稀硫酸和氢氧化钡反应生成硫酸钡沉淀放热,若是浓硫酸生成2mol水反应放热会大于114.6KJ,故B错误;
C、HCl(aq)+NaOH(s)=NaCl (aq)+H2O(l);△H=-57.3KJ/mol中强碱不是稀溶液状态,溶解过程放热,反应生成1mol水放出的热量高于57.3kJ,故C错误;
D、HI(aq)+KOH(aq)=KI(aq)+H2O(l);△H=-57.3KJ/mol表示强酸和强碱的稀溶液反应生成1mol水放出的热量,故D正确.
故选D.
B、H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)反应应该是稀硫酸和氢氧化钡反应生成硫酸钡沉淀放热,若是浓硫酸生成2mol水反应放热会大于114.6KJ,故B错误;
C、HCl(aq)+NaOH(s)=NaCl (aq)+H2O(l);△H=-57.3KJ/mol中强碱不是稀溶液状态,溶解过程放热,反应生成1mol水放出的热量高于57.3kJ,故C错误;
D、HI(aq)+KOH(aq)=KI(aq)+H2O(l);△H=-57.3KJ/mol表示强酸和强碱的稀溶液反应生成1mol水放出的热量,故D正确.
故选D.
点评:本题考查了中和热的概念理解和分析判断,关键是掌握中和热概念,弱电解质电离吸热,生成沉淀放热,题目难度中等.

练习册系列答案
相关题目
下列措施能减慢化学反应速率的是( )
| A、将煤块粉碎后燃烧 |
| B、将食物贮藏在冰箱中 |
| C、用氯酸钾制氧气时添加二氧化锰粉末作催化剂 |
| D、用粗锌替代纯锌与同浓度同体积的盐酸反应制氢气 |
下列有关化学用语表示正确的是( )
| A、氢的三种同位素:H2、D2、T2 |
B、F-的结构示意图: |
| C、中子数为20的氯原子:2017Cl |
D、NH3的电子式: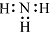 |
下列离子方程式正确的是( )
| A、过量氯气通入碘化亚铁溶液中:Cl2+Fe2++2I-=2Cl-十Fe3++I2 |
| B、向NaHCO3溶液中加入少量澄清石灰水:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32- |
| C、H218O中投入少量Na2O2固体:2H218O+2 Na2O2=4Na++4OH-+18O2↑ |
| D、向NaHSO4溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
下列对KHSO4的物质类型进行的分析,其中不正确的是( )
| A、根据元素组成知它是化合物 |
| B、因为含有钾元素与硫酸根,故KHSO4是钾盐 |
| C、KHSO4可以称为酸式盐 |
| D、因为它含有与酸相同的元素氢,故KHSO4也可称为酸 |
下列说法中错误的是( )
| A、同一元素的各种同位素的化学性质相似 |
| B、元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 |
| C、除氦外的稀有气体原子的最外层电子数都是8 |
| D、原子及其离子的核外电子层数等于该元素所在的周期数 |
下列叙述中正确的是( )
| A、VSEPR模型就是分子的空间构型 |
| B、在共价化合物分子中一定存在σ键 |
| C、全由非金属元素组成的化合物一定是共价化合物 |
| D、共价键键长越短,键能一定越大 |
