题目内容
用如图所示的装置进行实验,反应一段时间后断开K,向烧杯中加入0.1 mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH。下列说法中不正确的是

- A.铜棒为正极,其电极反应式为2H++2e-===H2↑
- B.烧杯右侧碳棒为阴极,其电极表面有红色物质析出
- C.反应中消耗锌的质量为13 g
- D.导线中通过电子的物质的量为0.2 mol
C
A 正确,锌的金属性大于铜,故铜为正极,其电极反应式为2H++2e-=H2↑
B 正确,烧杯右侧碳棒连接原电池的负极,所以是阴极,溶液中的铜离子得电子,有红色物质析出。
C 错误,向烧杯中加入0.1 mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH。相当于转移了0.2mol电子,根据转移电子数相等,反应中消耗锌的质量为6.5 g
D 正确,由c 可得,转移了0.2mol电子。
A 正确,锌的金属性大于铜,故铜为正极,其电极反应式为2H++2e-=H2↑
B 正确,烧杯右侧碳棒连接原电池的负极,所以是阴极,溶液中的铜离子得电子,有红色物质析出。
C 错误,向烧杯中加入0.1 mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH。相当于转移了0.2mol电子,根据转移电子数相等,反应中消耗锌的质量为6.5 g
D 正确,由c 可得,转移了0.2mol电子。

练习册系列答案
相关题目
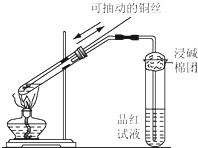 某同学用如图所示的装置进行铜与浓硫酸反应的实验.请回答问题.
某同学用如图所示的装置进行铜与浓硫酸反应的实验.请回答问题.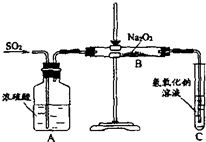
 某课外活动小组准备用如图所示的装置进行实验.现有甲、乙、丙三位同学分别选择了如下电极材料和电解质溶液:
某课外活动小组准备用如图所示的装置进行实验.现有甲、乙、丙三位同学分别选择了如下电极材料和电解质溶液: 用如图所示的装置进行电解.A中盛有AgNO3溶液,B中盛有饱和Na2SO4溶液通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色.则:
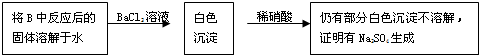
用如图所示的装置进行电解.A中盛有AgNO3溶液,B中盛有饱和Na2SO4溶液通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色.则: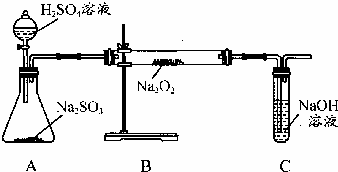 某化学学习小组的同学为探究过氧化钠与二氧化硫的反应,用如图所示的装置进行实验.通入足量的气体后将带火星的木条插入试管C中木条复燃.请回答下列问题
某化学学习小组的同学为探究过氧化钠与二氧化硫的反应,用如图所示的装置进行实验.通入足量的气体后将带火星的木条插入试管C中木条复燃.请回答下列问题