题目内容
 用如图所示的装置进行电解.A中盛有AgNO3溶液,B中盛有饱和Na2SO4溶液通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色.则:
用如图所示的装置进行电解.A中盛有AgNO3溶液,B中盛有饱和Na2SO4溶液通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色.则:(1)电源的F端为
正
正
极.(2)A中发生反应的化学方程式为
4AgNO3+2H2O
4Ag+O2+4HNO3
| ||
4AgNO3+2H2O
4Ag+O2+4HNO3
.
| ||
(3)在B中观察到的现象是
石墨极有气泡产生
石墨极有气泡产生
,Cu极周围变蓝色
Cu极周围变蓝色
,溶液中有蓝色沉淀生成
溶液中有蓝色沉淀生成
(4)室温下,若从电解开始到时间t s,A、B装置中共收集到标准状况下的气体0.168L,B中析出硫酸钠晶体(Na2SO4﹒10H2O)ωg.若电解过程中无其他副反应发生,经测定电解后,A中溶液体积恰为1000mL,则①A溶液的pH为
2
2
.②电解前饱和Na2SO4溶液的质量分数为
| 142w |
| 322(w+0.18) |
| 142w |
| 322(w+0.18) |
分析:(1)B中盛有饱和Na2SO4溶液通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色,说明生成碘,发生氧化反应,则C为阳极,D为阴极E为负极,F为正极;
(2)A为电解AgNO3溶液,阴极生成Ag,阳极生成氧气;
(3)B中盛有饱和Na2SO4溶液,Cu为阳极,阳极生成铜离子,阴极生成氢气,溶液生成氢氧化铜沉淀;
(4)A、B装置中共收集到标准状况下的气体0.168L,应分别为氧气和氢气,则氧气为0.168L×
=0.056L,n(02)=
=0.0025mol,转移电子0.01mol,以此解答该题.
(2)A为电解AgNO3溶液,阴极生成Ag,阳极生成氧气;
(3)B中盛有饱和Na2SO4溶液,Cu为阳极,阳极生成铜离子,阴极生成氢气,溶液生成氢氧化铜沉淀;
(4)A、B装置中共收集到标准状况下的气体0.168L,应分别为氧气和氢气,则氧气为0.168L×
| 1 |
| 3 |
| 0.056L |
| 22.4L/mol |
解答:解:(1)B中盛有饱和Na2SO4溶液通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色,说明生成碘,发生氧化反应,则C为阳极,D为阴极E为负极,F为正极,
故答案为:正;
(2)A为电解AgNO3溶液,阴极生成Ag,阳极生成氧气,方程式为4AgNO3+2H2O
4Ag+O2+4HNO3,
故答案为:4AgNO3+2H2O
4Ag+O2+4HNO3;
(3)B中盛有饱和Na2SO4溶液,Cu为阳极,阳极生成铜离子,Cu极周围变蓝色,阴极生成氢气,溶液生成氢氧化铜沉淀,
故答案为:石墨极有气泡产生;Cu极周围变蓝色; 溶液中有蓝色沉淀生成;
(4)A、B装置中共收集到标准状况下的气体0.168L,应分别为氧气和氢气,则氧气为0.168L×
=0.056L,n(02)=
=0.0025mol,转移电子0.01mol,
①A中盛有AgNO3溶液,电解时生成硝酸,n(H+)=n(e-)=0.01mol,则c(H+)=
=0.01mol/L,则pH=2,
故答案为:2;
②B中析出硫酸钠晶体(Na2SO4﹒10H2O)ωg,由于阳极生成铜离子,溶液中应生成氢氧化铜沉淀,可认为硫酸钠全部析出,则m(Na2SO4)=
g,
根据2H2O-2e-=2H++2OH-可知消耗水为0.01mol,质量为0.18g,则溶液质量为(w+0.18)g,
所以质量分数为
×100%,
故答案为:
×100%.
故答案为:正;
(2)A为电解AgNO3溶液,阴极生成Ag,阳极生成氧气,方程式为4AgNO3+2H2O
| ||
故答案为:4AgNO3+2H2O
| ||
(3)B中盛有饱和Na2SO4溶液,Cu为阳极,阳极生成铜离子,Cu极周围变蓝色,阴极生成氢气,溶液生成氢氧化铜沉淀,
故答案为:石墨极有气泡产生;Cu极周围变蓝色; 溶液中有蓝色沉淀生成;
(4)A、B装置中共收集到标准状况下的气体0.168L,应分别为氧气和氢气,则氧气为0.168L×
| 1 |
| 3 |
| 0.056L |
| 22.4L/mol |
①A中盛有AgNO3溶液,电解时生成硝酸,n(H+)=n(e-)=0.01mol,则c(H+)=
| 0.01mol |
| 1L |
故答案为:2;
②B中析出硫酸钠晶体(Na2SO4﹒10H2O)ωg,由于阳极生成铜离子,溶液中应生成氢氧化铜沉淀,可认为硫酸钠全部析出,则m(Na2SO4)=
| 142w |
| 322 |
根据2H2O-2e-=2H++2OH-可知消耗水为0.01mol,质量为0.18g,则溶液质量为(w+0.18)g,
所以质量分数为
| 142w |
| 322(w+0.18) |
故答案为:
| 142w |
| 322(w+0.18) |
点评:本题综合考查电解原理,侧重于考查学生综合运用电解知识的能力,题目难度较大,注意把握电解规律,能正确判断电极方程式.

练习册系列答案
相关题目
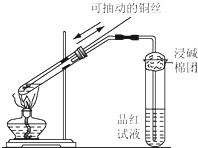 某同学用如图所示的装置进行铜与浓硫酸反应的实验.请回答问题.
某同学用如图所示的装置进行铜与浓硫酸反应的实验.请回答问题.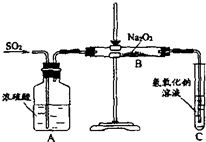
 某课外活动小组准备用如图所示的装置进行实验.现有甲、乙、丙三位同学分别选择了如下电极材料和电解质溶液:
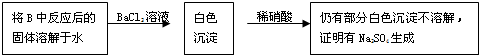
某课外活动小组准备用如图所示的装置进行实验.现有甲、乙、丙三位同学分别选择了如下电极材料和电解质溶液: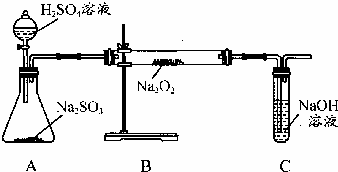 某化学学习小组的同学为探究过氧化钠与二氧化硫的反应,用如图所示的装置进行实验.通入足量的气体后将带火星的木条插入试管C中木条复燃.请回答下列问题
某化学学习小组的同学为探究过氧化钠与二氧化硫的反应,用如图所示的装置进行实验.通入足量的气体后将带火星的木条插入试管C中木条复燃.请回答下列问题