题目内容
醋酸在水溶液中存在下列电离平衡:CH3COOH?CH3COO-+H+下列说法不正确的是( )
| A、加入醋酸钠,平衡向左移动 |
| B、加入碳酸钠,平衡向右移动 |
| C、加水稀释,C(H+)减小 |
| D、加水稀释,溶液中仅有的三种离子浓度都减小 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A.加入CH3COONa,溶液中c(CH3COO-)增大,抑制CH3COOH电离;
B.加入Na2CO3,Na2CO3和H+反应生成二氧化碳,促进CH3COOH电离;
C.加水稀释促进CH3COOH电离,但醋酸电离增大程度小于溶液体积增大程度;
D.加水稀释促进CH3COOH电离,但溶液中c(OH-)增大.
B.加入Na2CO3,Na2CO3和H+反应生成二氧化碳,促进CH3COOH电离;
C.加水稀释促进CH3COOH电离,但醋酸电离增大程度小于溶液体积增大程度;
D.加水稀释促进CH3COOH电离,但溶液中c(OH-)增大.
解答:
解:A.加入CH3COONa,溶液中c(CH3COO-)增大,抑制CH3COOH电离,所以平衡向右移动,故A正确;
B.加入Na2CO3,Na2CO3和H+反应生成二氧化碳,促进CH3COOH电离,所以平衡向右移动,故B正确;
C.加水稀释促进CH3COOH电离,但醋酸电离增大程度小于溶液体积增大程度,所以溶液中C(H+)减小,故C正确;
D.加水稀释促进CH3COOH电离,但醋酸电离增大程度小于溶液体积增大程度,所以溶液中C(H+)减小,温度不变,水的离子积常数不变,则溶液中c(OH-)增大,故D错误;
故选D.
B.加入Na2CO3,Na2CO3和H+反应生成二氧化碳,促进CH3COOH电离,所以平衡向右移动,故B正确;
C.加水稀释促进CH3COOH电离,但醋酸电离增大程度小于溶液体积增大程度,所以溶液中C(H+)减小,故C正确;
D.加水稀释促进CH3COOH电离,但醋酸电离增大程度小于溶液体积增大程度,所以溶液中C(H+)减小,温度不变,水的离子积常数不变,则溶液中c(OH-)增大,故D错误;
故选D.
点评:本题考查了弱电解质的电离,根据溶液中离子浓度变化确定醋酸电离平衡移动方向,注意水的离子积常数、醋酸电离平衡常数只与无关有关,为易错点.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
下列说法中正确的是( )
| A、在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热 |
| B、酸和碱发生中和反应生成1mol水,这时的反应热叫中和热 |
| C、等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 |
| D、由单质A转化为单质B,△H=+119KJ/mol,可知单质A比单质B稳定 |
以下是一些常用的危险品标志,装运乙醇的包装箱应贴的图标是( )
A、 腐蚀品 |
B、 爆炸品 |
C、 有毒气体 |
D、 易燃液体 |
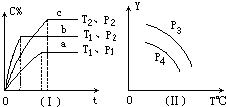 在某容积一定的密闭容器中,可逆反应:A(g)+B(g)?xC(g),符合下列图象(Ⅰ)所示关系.由此推断对图(Ⅱ)的正确说法是( )
在某容积一定的密闭容器中,可逆反应:A(g)+B(g)?xC(g),符合下列图象(Ⅰ)所示关系.由此推断对图(Ⅱ)的正确说法是( )| A、p3>p4,Y轴表示A的质量 |
| B、p3>p4,Y轴表示混合气体平均摩尔质量 |
| C、p3>p4,Y轴表示混合气体密度 |
| D、p3<p4,Y轴表示B的百分含量 |
下列有关氯水的叙述,正确的是( )
| A、新制氯水中只含有氯气和次氯酸分子 |
| B、新制氯水可使紫色石蕊试液先变红后褪色 |
| C、氯水光照时有气泡逸出,该气体的主要成分是氯气 |
| D、氯水放置数天后,其导电能力减弱 |
下列实验基本操作(或实验注意事项)中,主要是出于实验安全考虑的是( )
| A、可燃性气体的验纯 |
| B、过滤时玻璃棒不能在漏斗内搅拌 |
| C、使用分液漏斗前要检验是否漏液 |
| D、滴管不能交叉使用 |
 最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量.则下列说法正确的是( )
最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量.则下列说法正确的是( )| A、N4属于一种新型的化合物 |
| B、1mo1N4气体转变为N2将放出882kJ热量 |
| C、N4与N2互为同分异构体 |
| D、N4沸点比P4(白磷)沸点高 |
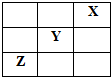 X、Y、Z是Ⅳ~ⅦA族的三种非金属元素,它们在周期表中的位置如图所示.试回答:
X、Y、Z是Ⅳ~ⅦA族的三种非金属元素,它们在周期表中的位置如图所示.试回答: