题目内容
下列说法正确的是( )
| A、F、Cl、Br的最外层电子数都是7,次外层电子数都是8 |
| B、从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属性递增规律 |
| C、卤素按F、Cl、Br、I的顺序其非金属性逐渐减弱的原因是随着核电荷数增加电子层数增大起主要作用 |
| D、砹是原子序数最大的卤族元素,根据卤素性质的递变规律,砹易溶于水,难溶于CCl4 |
考点:卤素原子结构及其性质的比较
专题:元素周期律与元素周期表专题
分析:A.F最外层电子数为2;
B.F、Cl、Br、I的非金属性逐渐减弱;
C.F、Cl、Br、I原子序数逐渐增大,非金属性逐渐减弱;
D.砹难溶于水,易溶于CCl4.
B.F、Cl、Br、I的非金属性逐渐减弱;
C.F、Cl、Br、I原子序数逐渐增大,非金属性逐渐减弱;
D.砹难溶于水,易溶于CCl4.
解答:
解:A.F位于周期表第二周期,次外层电子数为2,故A错误;
B.F、Cl、Br、I的非金属性逐渐减弱,但HF、HCl、HBr、HI酸性递增,故B错误;
C.F、Cl、Br、I位于同一主族,原子序数逐渐增大,非金属性逐渐减弱,故C正确;
D.砹单位为非极性分子,难溶于水,易溶于CCl4,故D错误.
故选C.
B.F、Cl、Br、I的非金属性逐渐减弱,但HF、HCl、HBr、HI酸性递增,故B错误;
C.F、Cl、Br、I位于同一主族,原子序数逐渐增大,非金属性逐渐减弱,故C正确;
D.砹单位为非极性分子,难溶于水,易溶于CCl4,故D错误.
故选C.
点评:本题考查卤素单质及其化合物的性质,侧重于周期律的考查,为高频考点,注意把握元素周期律的递变规律,难度不大.

练习册系列答案
相关题目
下列关于碱金属元素的叙述错误的是( )
| A、随核电荷数递增,碱金属单质的熔沸点逐渐减小 |
| B、随核电荷数递增,碱金属单质的密度逐渐增大(Na、K反常) |
| C、碱金属元素包括F、Cl、Br、I、At五种元素 |
| D、碱金属元素的原子最外层都只有一个电子 |
BaCl2有剧毒,致死量为0.8克,如万一不慎服用,应大量吞服鸡蛋清解毒,此外还应服用一定量的解毒剂,此解毒剂是( )
| A、AgNO3 |
| B、Na2SO4 |
| C、CuSO4 |
| D、Na2CO3 |
下列水解离子方程式正确的是( )
| A、醋酸钠:CH3COOˉ+H2O═CH3COOH+OHˉ |
| B、硫化钾:S2ˉ+2H2O?H2S+2 OHˉ |
| C、氯化铵:NH4++H2O?NH3?H2O+H+ |
| D、硫酸铁:Fe3++3 H2O?Fe(OH)3↓+3 H+ |
分子式为C4H8O2的有机物在酸性条件下可水解为酸和醇,若不考虑立体异构,这些醇和酸重新组合可形成的酯共有( )
| A、1种 | B、5种 | C、9种 | D、12种 |
下列关于铁及其化合物的说法中,不正确的是( )
| A、自然界中存在游离态铁 |
| B、铁在氧气中燃烧生成Fe2O3 |
| C、某些含铁的化合物可用作水处理剂 |
| D、铁红(Fe2O3)常用作红色油漆和涂料 |
有人建议将氢排在周期表的ⅦA族,能支持这一观点的是( )
①氢原子得一个电子实现最外电子层稳定结构;
②氢气分子中氢原子间的化学键是共价键;
③氢元素与碱金属元素可形成离子化合物M+[:H]-.
①氢原子得一个电子实现最外电子层稳定结构;
②氢气分子中氢原子间的化学键是共价键;
③氢元素与碱金属元素可形成离子化合物M+[:H]-.
| A、①② | B、①③ | C、②③ | D、①②③ |
世博会中国馆、主题馆等建筑使用光伏并网发电,总功率达4兆瓦,是历届世博会之最.通过并网,上海市使用半导体照明(LED).已知发出白光的LED是由GaN芯片和钇铝石榴石(YAG,化学式:Y3Al5O12)芯片封装在一起做成的.下列有关叙述正确的是( )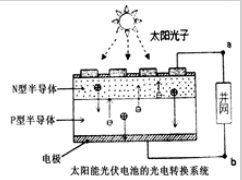

| A、光伏电池是将太阳能直接转变为电能 |
| B、图中N型半导体为正极,P型半导体为负极 |
| C、电流从a流向b |
| D、LED中的Ga和Y都显+3价 |
下列关于油脂的叙述错误的是( )
| A、从溴水中提取溴可用植物油做萃取剂 |
| B、用热的纯碱溶液可区别植物油和矿物油 |
| C、含Ca2+、Mg2+的水使肥皂去污能力减弱是因为发生了沉淀反应 |
| D、生产盐酸和人造脂肪必须用氢气做原料 |