题目内容
甲、乙、丙三种物质之间有如下转化关系:甲
乙
丙
甲;若甲是不溶于水的白色粉末状物质,既能溶于盐酸又能溶于氢氧化钠溶液.
①甲物质是 (填化学式).写出甲的一种主要用途 .
②写出“乙→丙”转化的离子方程式: .
③写出丙受热分解的化学方程式: .
④向20mL乙溶液中滴入2mol?L-1NaOH溶液时,沉淀质量与所滴加NaOH溶液体积(mL)关系如图所示,试写出图中所示的AB段所发生的反应的离子方程式为: ;假设溶液中有沉淀0.39g,则此时用去NaOH溶液的体积为 .

| HCl |
| NH3?H2O |
| △ |
①甲物质是
②写出“乙→丙”转化的离子方程式:
③写出丙受热分解的化学方程式:
④向20mL乙溶液中滴入2mol?L-1NaOH溶液时,沉淀质量与所滴加NaOH溶液体积(mL)关系如图所示,试写出图中所示的AB段所发生的反应的离子方程式为:

考点:无机物的推断
专题:推断题
分析:甲、乙、丙三种物质之间有如下转化关系:甲
乙
丙
甲;若甲是不溶于水的白色粉末状物质,既能溶于盐酸又能溶于氢氧化钠溶液,由转化关系可知,甲为Al2O3、乙为AlCl3、丙为Al(OH)3.
①甲为Al2O3,熔点很高,可以用于耐火材料;
②氯化铝与氨水反应生成氢氧化铝沉淀与氯化铵;
③氢氧化铝分解生成氧化铝与水;
④AB段是氢氧化铝与氢氧化钠反应生成偏铝酸钠与水;溶液中有沉淀0.39g<0.78g,故有两种情况,一是氢氧化钠不足,部分铝离子转化氢氧化铝沉淀,二是氢氧化钠足量,铝离子全部转化为氢氧化铝沉淀后又部分溶解,结合方程式计算解答.
| HCl |
| NH3?H2O |
| △ |
①甲为Al2O3,熔点很高,可以用于耐火材料;
②氯化铝与氨水反应生成氢氧化铝沉淀与氯化铵;
③氢氧化铝分解生成氧化铝与水;
④AB段是氢氧化铝与氢氧化钠反应生成偏铝酸钠与水;溶液中有沉淀0.39g<0.78g,故有两种情况,一是氢氧化钠不足,部分铝离子转化氢氧化铝沉淀,二是氢氧化钠足量,铝离子全部转化为氢氧化铝沉淀后又部分溶解,结合方程式计算解答.
解答:
解:甲、乙、丙三种物质之间有如下转化关系:甲
乙
丙
甲;若甲是不溶于水的白色粉末状物质,既能溶于盐酸又能溶于氢氧化钠溶液,由转化关系可知,甲为Al2O3、乙为AlCl3、丙为Al(OH)3.
①甲为Al2O3,熔点很高,可以用于耐火材料,故答案为:Al2O3;耐火材料;
②氯化铝与氨水反应生成氢氧化铝沉淀与氯化铵,反应离子方程式为:Al3++3NH3.H2O=Al(OH)3↓+3NH4+,故答案为:Al3++3NH3.H2O=Al(OH)3↓+3NH4+;
③氢氧化铝分解生成氧化铝与水,反应方程式为:2Al(OH)3
Al2O3+3H2O,故答案为:2Al(OH)3
Al2O3+3H2O;
④AB段是氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O;
溶液中有沉淀0.39g<0.78g,0.39g氢氧化铝的物质的量为
=0.005mol,有两种情况:
一是氢氧化钠不足,部分铝离子转化氢氧化铝沉淀,
Al3++3OH-=Al(OH)3↓
0.015mol 0.005mol
故需要氢氧化钠溶液体积为
=0.0075L=7.5mL,
二是氢氧化钠足量,铝离子全部转化为氢氧化铝沉淀后又部分溶解,0.78g氢氧化铝为
=0.01mol,
Al3++3OH-=Al(OH)3↓
0.03mol 0.01mol
Al(OH)3+OH-=AlO2-+2H2O
(0.01-0.005)mol (0.01-0.005)mol
故需要氢氧化钠为0.03mol+(0.01-0.005)mol=0.035mol,需要氢氧化钠溶液体积为
=0.0175L=17.5mL,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;7.5mL或17.5mL.
| HCl |
| NH3?H2O |
| △ |
①甲为Al2O3,熔点很高,可以用于耐火材料,故答案为:Al2O3;耐火材料;
②氯化铝与氨水反应生成氢氧化铝沉淀与氯化铵,反应离子方程式为:Al3++3NH3.H2O=Al(OH)3↓+3NH4+,故答案为:Al3++3NH3.H2O=Al(OH)3↓+3NH4+;
③氢氧化铝分解生成氧化铝与水,反应方程式为:2Al(OH)3
| ||
| ||
④AB段是氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O;
溶液中有沉淀0.39g<0.78g,0.39g氢氧化铝的物质的量为
| 0.39g |
| 78g/mol |
一是氢氧化钠不足,部分铝离子转化氢氧化铝沉淀,
Al3++3OH-=Al(OH)3↓
0.015mol 0.005mol
故需要氢氧化钠溶液体积为
| 0.015mol |
| 2mol/L |
二是氢氧化钠足量,铝离子全部转化为氢氧化铝沉淀后又部分溶解,0.78g氢氧化铝为
| 0.78g |
| 78g/mol |
Al3++3OH-=Al(OH)3↓
0.03mol 0.01mol
Al(OH)3+OH-=AlO2-+2H2O
(0.01-0.005)mol (0.01-0.005)mol
故需要氢氧化钠为0.03mol+(0.01-0.005)mol=0.035mol,需要氢氧化钠溶液体积为
| 0.035mol |
| 2mol/L |
故答案为:Al(OH)3+OH-=AlO2-+2H2O;7.5mL或17.5mL.
点评:本题考查无机物推断,涉及Al元素化合物性质与转化,难度中等,明确各阶段发生的反应注意讨论计算.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )| A、反应的化学方程式为:2 N?M |
| B、t2时,正逆反应速率相等,达到平衡 |
| C、t3时,正反应速率大于逆反应速率 |
| D、t1时,N的浓度是M浓度的2倍 |
新型塑料膜材料ETFE[名称为聚氟乙烯,化学式(C2H2F2)n],美观、耐用,可以使用15至20年.以下关于聚氟乙烯的说法不正确的是( )
| A、聚氟乙烯属于有机物 |
| B、聚氟乙烯是加聚反应的产物 |
| C、聚氟乙烯溶于水,易与空气中的氧气反应 |
| D、聚氟乙烯中碳元素的质量分数为37.5% |
关于有机物 的叙述错误的是( )
的叙述错误的是( )
 的叙述错误的是( )
的叙述错误的是( )| A、分子式为C6H8O |
| B、含有羟基 |
| C、含有甲基 |
| D、含有苯环结构 |
下列可以用来区分甲烷、乙烯、乙炔的是( )
| A、用溴水区分 |
| B、用酸性高锰酸钾溶液区分 |
| C、根据燃烧现象不同区分 |
| D、根据气味不同区分 |
下列氧化物中,既溶于氢氧化钠溶液又溶于盐酸的( )
| A、SiO2 |
| B、Al2O3 |
| C、Fe2O3 |
| D、CuO |
下列说法中错误的是( )
| A、硅酸是不挥发性酸,因此不能由盐酸制得 |
| B、氢氟酸能和玻璃发生化学反应,所以氢氟酸要存放在塑料瓶中 |
| C、水玻璃有黏性,所以要存放在带橡胶塞的试剂瓶中 |
| D、烧碱溶液会腐蚀玻璃并生成硅酸钠,所以烧碱溶液要存放在带橡胶塞的试剂瓶里 |
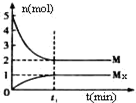 E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:xM(g)?Mx(g),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )
E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:xM(g)?Mx(g),反应物和生成物的物质的量随时间的变化关系如图.下列说法正确的是( )| A、该反应的化学方程式是2HF?(HF)2 | ||
B、t1时刻,保持温度不变,再充入1molM,重新达到平衡时,
| ||
| C、平衡时混合气体的平均摩尔质量是33.3 | ||
| D、M的沸点比同主族下一周期元素的气态氢化物沸点低 |