题目内容
4.印尼火山喷发不仅带来壮观的美景,还给附近的居民带来物质财富,有许多居民冒着生命危险在底部的火山口收集纯硫磺块来赚取丰厚收入.硫磺可用于生产化工原料硫酸.某工厂用如图所示的工艺流程生产硫酸:
请回答下列问题:
(1)为充分利用反应放出的热量,接触室中应安装热交换器(填设备名称).吸收塔中填充有许多瓷管,其作用是增加SO3与浓硫酸的接触面积,有利于SO3的吸收.
(2)为使硫磺充分燃烧,经流量计1通入燃烧室的氧气过量50%,为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为6:5.假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为0.4%(空气中氧气的体积分数按0.2计),该尾气的处理方法是用氨水吸收.
(3)与以硫铁矿为原料的生产工艺相比,该工艺的特点是AC(可多选).
A.耗氧量减少 B.二氧化硫的转化率提高 C.产生的废渣减少 D.不需要使用催化剂
(4)硫酸的用途非常广,可应用于下列哪些方面BCD.
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸钠”的合成 C.铅蓄电池的生产 D.过磷酸钙的制备
(5)矿物燃料的燃烧是产生大气中SO2的主要原因之一.在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑、SO2+CaO$\frac{\underline{\;高温\;}}{\;}$CaSO3、2CaSO3+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4,或(2CaCO3+O2+2SO2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2).
分析 (1)SO2与O2的反应为放热反应,为了充分利用能量,应安装热交换器;吸收塔中填充许多瓷管,增大三氧化硫与浓硫酸的接触面,有利于三氧化硫的吸收.
(2)假设SO2的体积为x,经流量计1通入燃烧室的氧气过量50%,则流量计1中通入氧气的体积为1.5x,经流量计2的氧气量为接触室中SO2完全氧化时理论需氧量的2.5倍,则流量计2中通入氧气的体积为2.5×0.5x=1.25x,据此分析解答;
(3)A.硫铁矿中铁的氧化需要消耗O2;
B.原料选择与SO2的转化率无关;
C.用硫铁矿为原料产生的废渣较多,用硫产生的废渣减少,废气量是相同的;
D.用SO2制取SO3的过程中都需要使用催化剂;
(4)A.橡胶硫化所用到的为单质硫;
B.烷基苯磺酸钠中含有磺酸基,制取过程中需要发生磺化反应;
C.铅蓄电池中需要用到硫酸和硫酸铅;
D.过磷酸钙的制取过程中需要浓硫酸和磷矿石;
(5)CaCO3高温分解生成CO2和CaO,SO2为酸性氧化物,可以和碱性氧化物CaO反应生成CaSO3,而CaSO3易被氧化为CaSO4.
解答 解:(1)SO2与O2的反应为放热反应,为了充分利用能量,应安装热交换器;吸收塔中填充许多瓷管,增大三氧化硫与浓硫酸的接触面,有利于三氧化硫的吸收,
故答案为:热交换器;增加SO3与浓硫酸的接触面积,有利于SO3的吸收;
(2)燃烧室中的反应为S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,假设SO2的体积为x,则流量计1中通入氧气的体积为1.5x,接触室中的反应为2SO2+O2$?_{△}^{催化剂}$2SO3,则流量计2中通入氧气的体积为1.25x;流量计1中通入空气的体积为7.5x,流量计2中通入空气的体积为6.25x,故流经流量计1和流量计2的空气体积比应为7.5x:6.25x=6:5;燃烧室剩余空气6.5x,接触室剩余空气6.25x-x=5.775x,剩余SO2为0.05x,故b管尾气中SO2的体积分数为0.4%;SO2为酸性氧化物,可以用碱液(如氨水)吸收,
故答案为:6:5;0.4%; 用氨水吸收;
(3)硫铁矿中铁的氧化需要消耗O2,故A项正确;原料选择与SO2的转化率无关,故B项错误;用硫铁矿为原料产生的废渣较多,用硫产生的废渣减少,废气量是相同的,故C项正确;用SO2制取SO3的过程中都需要使用催化剂,D项错误,
故答案为:AC;
(4)橡胶硫化所用到的为单质硫,A项错误;烷基苯磺酸钠中含有磺酸基,制取过程中需要发生磺化反应,B项正确;铅蓄电池中需要用到硫酸和硫酸铅,C项正确;过磷酸钙的制取过程中需要浓硫酸和磷矿石,D项正确,
故答案为:BCD;
(5)CaCO3高温分解生成CO2和CaO,SO2为酸性氧化物,可以和碱性氧化物CaO反应生成CaSO3,而CaSO3易被氧化为CaSO4,
所以发生反应的化学方程式为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ SO2+CaO$\frac{\underline{\;高温\;}}{\;}$CaSO3 2CaSO3+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4,或(2CaCO3+O2+2SO2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2);
故答案为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑、SO2+CaO$\frac{\underline{\;高温\;}}{\;}$CaSO3、2CaSO3+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4,或(2CaCO3+O2+2SO2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2).
点评 本题是对化学与技术及工业生产的考查,需要学生细读生产工艺图中各物质的变化进行解答,把握制备浓硫酸的工艺流程及设备的作用、发生的化学反应为解答的关键,题目难度中等.

| A. | 酶是具有催化作用的蛋白质 | |
| B. | 酶的催化作用具有选择性和专一性 | |
| C. | 高温或重金属盐能使酶失去生理活性 | |
| D. | 酶只有在强酸性或强碱性条件下才能发挥作用 |
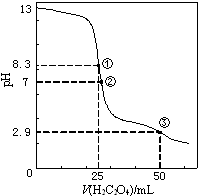 25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法正确的是( )
25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法正确的是( )| A. | 点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4-)=c(OH-) | |
| B. | 点②所示溶液中:c(HC2O4-)+2c(C2O42-)=c(Na+)+c(H+) | |
| C. | 点③所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| D. | 滴定过程中可能出现:c(Na+)>c(C2O42-)=c(HC2O4-)>c(H+)>c(OH-) |

| A. | 钢钉表面有白色沉淀 | B. | 实验2中的高锰酸钾溶液先变色 | ||
| C. | 负极的电极反应为:Fe-3e-→Fe3+ | D. | 铁钉表面有红褐色物质生成 |
| A. | 滴定前滴定管中有气泡,滴定后消失 | |
| B. | 碱式滴定管量取NaOH溶液时,未进行润洗操作 | |
| C. | 滴定时达到滴定终点时仰视读数 | |
| D. | 锥形瓶取用NaOH待测液前加少量水洗涤 |
CH3COOH?H++CH3COO- Ka=1.8×10-5
KSP[Mg(OH)2]=1.8×10-11、KSP[Zn(OH)2]=1.2×10-17、KSP[Cd(OH)2]=2.5×10-14
又已知:$\sqrt{5}$=2.2
下列说法正确的是( )
| A. | 醋酸钠水解的平衡常数Kh随温度升高而减小 | |
| B. | 0.5mol•L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol•L-1醋酸钠溶液pH为n,水解的程度为b,则m<n、a>b | |
| C. | 醋酸钠的水解的平衡常数Kh=KW•Ka | |
| D. | 在某溶液中含Mg2+、Cd2+、Zn2+三种离子的浓度均为0.01mol•L-1,向其中加入固体醋酸钠,使其浓度为0.9mol•L-1,以上三种金属离子中只有Zn2+能生成沉淀 |
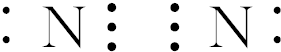 ,
, ,
, .
.