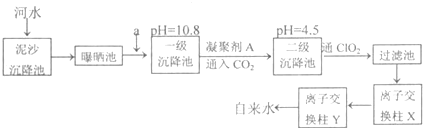
题目内容
设阿伏加德罗常数为NA,则下列说法正确的是( )
| A、常温下,5.6g铁与足量盐酸反应,转移电子数为0.3NA |
| B、1NA个氢气分子所占的体积为22.4L |
| C、在常温常压下,1mol氦气含有的原子数为NA |
| D、23g钠与足量的氧气在常温或加热条件充分反应失去电子数目均为为NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.铁与盐酸反应生成的是亚铁离子;
B.没有告诉在标准状况下,不能使用标况下的气体摩尔体积计算氢气的体积;
C.稀有气体为单原子分子,1mol氦气含有1mol氦原子;
D.钠为1价金属,23g钠的物质的量为1mol,完全反应失去1mol电子.
B.没有告诉在标准状况下,不能使用标况下的气体摩尔体积计算氢气的体积;
C.稀有气体为单原子分子,1mol氦气含有1mol氦原子;
D.钠为1价金属,23g钠的物质的量为1mol,完全反应失去1mol电子.
解答:
解:A.5.6g铁的物质的量为0.1mol,0.1mol铁与足量盐酸反应失去0.2mol电子,转移电子数为0.2NA,故A错误;
B.1NA个氢气分子的物质的量为1mol,不是在标况下,题中条件无法计算1mol氢气的体积,故B错误;
C.1mol氦气含有1mol氦原子,含有的原子数为NA,故C正确;
D.23g钠的物质的量为1mol,1mol钠完全反应失去1mol电子,失去电子数目均为为NA,故D正确;
故选CD.
B.1NA个氢气分子的物质的量为1mol,不是在标况下,题中条件无法计算1mol氢气的体积,故B错误;
C.1mol氦气含有1mol氦原子,含有的原子数为NA,故C正确;
D.23g钠的物质的量为1mol,1mol钠完全反应失去1mol电子,失去电子数目均为为NA,故D正确;
故选CD.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确稀有气体为单原子分子及标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
能用H++OH-=H2O来表示的化学反应是( )
| A、氢氧化铜和稀盐酸反应 |
| B、Ba(OH)2溶液中滴入稀硫酸 |
| C、KOH溶液和稀硝酸反应 |
| D、CH3COOH与NaOH溶液反应 |
含氢氧化钠0.25mol的稀溶液与足量的稀盐酸反应,放出14.35kJ的热量,表示该反应的热化学方程式是( )
| A、NaOH (aq)+HCl (aq)═NaCl (aq)+H2O (l)△H=-14.35 kJ?mol-1 |
| B、NaOH (aq)+HCl (aq)═NaCl (aq)+H2O (l)△H=-28.70 kJ?mol-1 |
| C、NaOH+HCl═NaCl+H2O△H=-57.40 kJ?mol-1 |
| D、NaOH (aq)+HCl (aq)═NaCl (aq)+H2O (l)△H=-57.40 kJ?mol-1 |
下列说法中正确的是( )
| A、某无色溶液中可能含有下列离子:H+、Cl-、Na+、Fe2+ |
| B、能使石蕊变红的溶液中可能含有Cl-、K+、Na+、NO3- |
| C、取少量某溶液,向其中加入盐酸酸化的BaCl2溶液,通过观察是否有白色沉淀生成,可证明该溶液中是否含有SO42- |
| D、H++OH-═H2O可描述所有酸碱中和反应的实质 |
对于1molCO2,下列说法错误的是(NA代表阿伏加德罗常数)( )
| A、含有的分子数为NA |
| B、含有氧原子2mol |
| C、体积是22.4L |
| D、质量是44g |
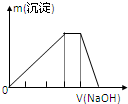 某盐A是含有两种阳离子的硫酸盐,将该溶液溶于水,向溶液中滴加NaOH溶液生成沉淀的物质的量与NaOH体积关系如图所示,下列离子溶液中能大量共存,加入晶体A后仍能大量共存的是( )
某盐A是含有两种阳离子的硫酸盐,将该溶液溶于水,向溶液中滴加NaOH溶液生成沉淀的物质的量与NaOH体积关系如图所示,下列离子溶液中能大量共存,加入晶体A后仍能大量共存的是( )| A、Na+、H+、Cl-、NO3- |
| B、K+、Ba2+、OH-、I- |
| C、Mg2+、Fe3+、Br-、HCO3- |
| D、Na+、Mg2+、Cl-、AlO2- |
下列说法中正确的是( )
| A、硫酸的摩尔质量是98g |
| B、2mol水的质量是18g/mol |
| C、氯化氢的摩尔质量等于它的相对分子质量 |
| D、22g二氧化碳的物质的量是0.5mol |
下列实验操作中,不符合操作规范的是( )
A、 渗析 |
B、 定容 |
C、 过滤 |
D、 闻Cl2的气味 |