题目内容
9.下列离子方程式书写正确的是( )| A. | 向漂白粉溶液中通入少量SO2:Ca2++2ClO-+2H2O+SO2═CaSO3↓+2HClO | |
| B. | 实验室用石灰石制备CO2:CO32-+2H+═CO2↑+H2O | |
| C. | 向NH4HCO3溶液中加入足量稀NaOH溶液:NH4++OH-═NH3•H2O | |
| D. | 向NaOH溶液中通入少量Cl2:Cl2+2OH-═ClO-+Cl-+H2O |
分析 A.次氯酸根能够氧化二氧化硫生成硫酸根离子;
B.碳酸钙为沉淀,应保留化学式;
C.漏掉碳酸氢根离子与氢氧根离子的反应;
D.反应生成氯化钠、次氯酸钠和水.
解答 解:A.少量SO2通入Ca(ClO)2溶液中,离子方程式:SO2+Ca2++ClO-+H2O=CaSO4↓+2H++Cl-,故A错误;
B.实验室用石灰石制备CO2,离子方程式:CaCO3+2H+═CO2↑+H2O+Ca2+,故B错误;
C.向NH4HCO3溶液中加入足量稀NaOH溶液:HCO3-+NH4++2OH-═NH3•H2O+CO32-,故C错误;
D.向NaOH溶液中通入少量Cl2,离子方程式:Cl2+2OH-═ClO-+Cl-+H2O,故D正确;
故选:D.
点评 本题考查了离子方程式书写,明确反应实质是解题关键,注意次氯酸根离子的氧化性,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.现有下列物质:①1mol NH3;②标准状态下,11.2L N2;③4℃时18mL水;④标准状态下22.4L CH4,原子数由多到少的排列顺序是( )
| A. | ④①②③ | B. | ④②①③ | C. | ②④①③ | D. | ④①③② |
20.下列描述中正确的是( )
| A. | ClO3-的空间构型为平面三角形 | |
| B. | SiF4 和 SO32-的中心原子均为 sp3 杂化 | |
| C. | 在所有的元素中,氟的第一电离能最大 | |
| D. | C2H5OH 分子中共含有 8 个极性键,1 个 π 键 |
17.在一定温度下,用蒸馏水稀释醋酸溶液,随着醋酸浓度的降低,下列始终保持增大趋势的量的是( )
| A. | c(H+) | B. | H+个数 | C. | CH3COOH分子数 | D. | c(H+)/c(CH3COOH) |
4.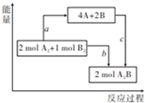 已知25℃、101kPa下,断开1molA-A、1molB-B、1molA-B键时需要吸收436kJ、498kJ、463kJ的能量,如图是相同条件下,反应2A2+B2$\frac{\underline{\;点燃\;}}{\;}$2A2B的能量关系图.下列说法中产物的是( )
已知25℃、101kPa下,断开1molA-A、1molB-B、1molA-B键时需要吸收436kJ、498kJ、463kJ的能量,如图是相同条件下,反应2A2+B2$\frac{\underline{\;点燃\;}}{\;}$2A2B的能量关系图.下列说法中产物的是( )
 已知25℃、101kPa下,断开1molA-A、1molB-B、1molA-B键时需要吸收436kJ、498kJ、463kJ的能量,如图是相同条件下,反应2A2+B2$\frac{\underline{\;点燃\;}}{\;}$2A2B的能量关系图.下列说法中产物的是( )
已知25℃、101kPa下,断开1molA-A、1molB-B、1molA-B键时需要吸收436kJ、498kJ、463kJ的能量,如图是相同条件下,反应2A2+B2$\frac{\underline{\;点燃\;}}{\;}$2A2B的能量关系图.下列说法中产物的是( )| A. | a=1370kJ | |
| B. | 该反应是吸热反应 | |
| C. | A、B原子更易结合生成A2B | |
| D. | 反应的能量转化形式,由化学能转化为热能 |
19. 工业合成氨原理N2(g)+3H2(g)?2NH3(g)△H<0.在一定条件下达化学平衡后,在t时突然改变条件,反应速率的变化如右图所示,则t时所改变的条件是( )
工业合成氨原理N2(g)+3H2(g)?2NH3(g)△H<0.在一定条件下达化学平衡后,在t时突然改变条件,反应速率的变化如右图所示,则t时所改变的条件是( )
 工业合成氨原理N2(g)+3H2(g)?2NH3(g)△H<0.在一定条件下达化学平衡后,在t时突然改变条件,反应速率的变化如右图所示,则t时所改变的条件是( )
工业合成氨原理N2(g)+3H2(g)?2NH3(g)△H<0.在一定条件下达化学平衡后,在t时突然改变条件,反应速率的变化如右图所示,则t时所改变的条件是( )| A. | 增大压强 | B. | 降低温度 | C. | 升高温度 | D. | 分离出氨气 |

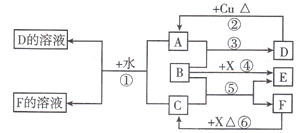
 .根据图中信息,B、C、X的氧化性由强到弱的顺序是MnO2>Cl2>H2O2(用化学式表示).
.根据图中信息,B、C、X的氧化性由强到弱的顺序是MnO2>Cl2>H2O2(用化学式表示).