题目内容
在保持平衡的天平的左右两盘中各放一只大小和质量均相同的烧杯,两烧杯中都盛有1 mol·L-1的稀硫酸100 mL,然后分别向两烧杯中加入一定质量的金属,充分反应后天平仍保持平衡,则金属的质量分别是
- A.4.6gNa,4.8gMg
- B.5gNa,5gAl
- C.2.3gNa,2.4gMg
- D.1.8 gAl,2.4gMg
C
反应后溶液的增重相等,则天平仍会保持平衡.A项金属过量,生成气体的质量由硫酸的量决定,反应后生成氢气的量相等,但所加入金属的质量不等,不符合题意.B项中金属过量,但钠还会与水反应,生成氢气的量多.C项反应后溶液的增重相等,因此天平仍然保持平衡.D项两种金属与稀硫酸都恰好完全反应,生成氢气的量相等,但金属的加入量不等,因此也不符合题意.
反应后溶液的增重相等,则天平仍会保持平衡.A项金属过量,生成气体的质量由硫酸的量决定,反应后生成氢气的量相等,但所加入金属的质量不等,不符合题意.B项中金属过量,但钠还会与水反应,生成氢气的量多.C项反应后溶液的增重相等,因此天平仍然保持平衡.D项两种金属与稀硫酸都恰好完全反应,生成氢气的量相等,但金属的加入量不等,因此也不符合题意.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
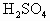 各20mL,向左盘的烧杯中加入10g的Zn,为了保持天平的平衡,应当向右盘的烧杯中放入铁的质量是
各20mL,向左盘的烧杯中加入10g的Zn,为了保持天平的平衡,应当向右盘的烧杯中放入铁的质量是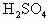 各20mL,向左盘的烧杯中加入10g的Zn,为了保持天平的平衡,应当向右盘的烧杯中放入铁的质量是
各20mL,向左盘的烧杯中加入10g的Zn,为了保持天平的平衡,应当向右盘的烧杯中放入铁的质量是