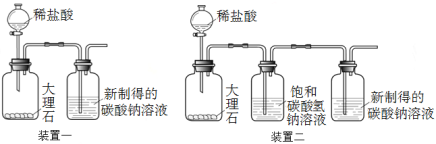
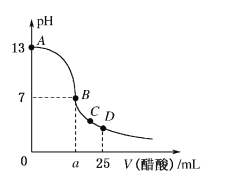
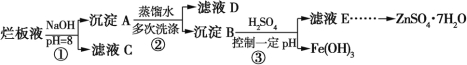
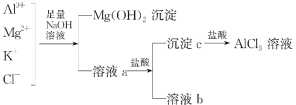
题目内容
【题目】已知在25℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)=1.8×1010,Ksp(AgY)=1.0×1012,Ksp(AgZ)=8.7×1017;
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度S(AgX)、S(AgY)、S(AgZ)的大小顺序为:_________。
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y)________(填“增大”、“减小”或“不变”)。
(3)在25℃时,若取0.188 g的AgY(相对分子质量188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Y的物质的量浓度为______________。
(4)①由上述Ksp判断,在上述(3)的体系中,能否实现AgY向AgZ的转化,并简述理由:_____________。
②在上述(3)的体系中,能否实现AgY向AgX的转化?
下面根据你的观点选答一项。
若不能,请简述理由:___________________________________。
若能,则实现转化的必要条件是:__________________________________________。
【答案】(1)S(AgX)>S(AgY)>S(AgZ) (2)减小 (3)1.0×106mol·L1
(4)①能,Ksp(AgY)=1.0×1012>Ksp(AgZ)=8.7×1017
②当溶液中c(X)≥1.8×104mol·L1时,AgY开始向AgX转化
【解析】(1)对同类型的难溶电解质,在相同温度下,Ksp越大,溶解度就越大;Ksp越小,溶解度就越小。则S(AgX)>S(AgY)>S(AgZ)。
(2)向AgY的饱和溶液中加入少量的AgX固体,S(AgX)>S(AgY),AgX的溶解度大于AgY,溶液中的c(Ag+)增大,AgY的溶解平衡向着形成沉淀的方向移动,c(Y)减小。
(3)AgY饱和溶液中,c(Ag+)=![]() =
=![]() =1.0×106(mol·L1),假设AgY固体完全溶解,c(Ag+)=1.0×102mol·L1,故0.188 g AgY不能完全溶解,其溶液中c(Y)=1.0×106mol·L1。
=1.0×106(mol·L1),假设AgY固体完全溶解,c(Ag+)=1.0×102mol·L1,故0.188 g AgY不能完全溶解,其溶液中c(Y)=1.0×106mol·L1。
(4)①Ksp(AgY)=1.0×1012>Ksp(AgZ)=8.7×1017,故能转化。②当溶液中c(X)>![]() mol·L1=1.8×104 mol·L1时,AgY开始向AgX转化。
mol·L1=1.8×104 mol·L1时,AgY开始向AgX转化。

 名校课堂系列答案
名校课堂系列答案