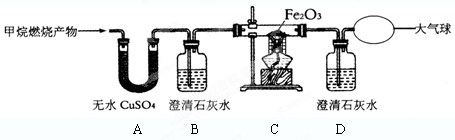
(7分)为了对一包放置很久的干燥剂(主要成分是生石灰)进行探究,小凡提出了两项探究任务:
(1)探究干燥剂是否失效;
(2)探究失效的干燥剂的主要成分是否是氢氧化钙。
他设计了以下的探究方案:
| 问题与猜想 | 实验步骤 | 实验现象 | 实验结论 |
| (1)干燥剂是否失效 | 取样品放入试管中加适量的水,触摸试管壁。 | | 干燥剂失效 |
| (2)失效的干燥剂中含有氢氧化钙 | 加水充分搅拌、过滤后,用pH试纸测其溶液的pH值 | | 有氢氧化钙 |
。你认为以CaO为主要成分的干燥剂在空气中放置久了,除能转化为Ca(OH)2外,还可能转化为 ,请简单说明验证的思路 。
(8分)某实验小组对“载人宇宙飞船或潜水艇中一般都要安装盛放过氧化钠(Na2O2)颗粒的装置”感到非常好奇,设计实验进行探究。
【提出问题】过氧化钠是否为一种制氧剂?与人呼出的哪种气体发生反应?
【查阅资料】① 人呼出的气体中主要成分是N2、O2、CO2和水蒸气等。
② CO2 + 2NaOH=Na2CO3 + H2O。
【提出猜想】过氧化钠与人呼出的N2或CO2或水蒸气反应并生成氧气。
【进行实验】
实验Ⅰ:验证过氧化钠与氮气反应并生成氧气。
(1)实验操作如右图所示。
(2)实验现象及结论:观察到________现象,
判断过氧化钠与氮气没有发生反应。
实验Ⅱ:验证过氧化钠与水蒸气反应并生成氧气。
(1)同学们在老师的指导下设计了如下图所示装置。其中A装置的作用是_______,发生的变化是________变化。
A B C
(2)实验现象及结论:带火星的木条复燃;过氧化钠与水蒸气发生反应并生成氧气。
实验Ⅲ:验证过氧化钠与二氧化碳反应并生成氧气。
(1)同学们在老师的指导下设计了如下图所示装置。(提示:C装置中的氢氧化钠溶液用于吸收可能未反应的二氧化碳)
A B C D
(2)实验记录
| 实验操作 | 主要实验现象 | 实验结论及解释 | |
| ① | 检查装置的气密性。 向装置中加入药品。 | | 装置的气密性良好。 |
| ② | 打开分液漏斗活塞,向A装置中缓慢加入稀盐酸。 | A装置中观察到的现象有________,C装置中有气泡出现。 | A装置中发生反应的化学方程式为________; |
| ③ | 一段时间后用带火星的木条在D内进行检验。 | 带火星的木条复燃。 | 过氧化钠与二氧化碳反应并生成氧气。 |
(1)根据实验Ⅱ和Ⅲ,过氧化钠与二氧化碳或水蒸气反应后,还产生了另一种物质,该物质是_______ _(填“单质”或“化合物”)。
(2)某同学对实验Ⅲ的设计提出疑问:该实验不能证明二氧化碳与过氧化钠确实发生了反应,你认为他的理由是______ __。
(8分)为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验。
| 实验编号 | 实验操作 | 实验现象 |
| ① | 分别在试管A、B中加入 5 mL 5%(溶液浓度) H2O2溶液,各滴入2 滴相同浓度的CuSO4溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。 | 试管A中不再产生气泡; 试管B中产生的气泡量增大。 |
| ② | 另取两支试管分别加入5mL 5%H2O2溶液和5 mL 10%H2O2溶液 | 试管A、B中均未明显见到有气泡产生。 |
(2)实验①的目的是 。
实验中滴加CuSO4溶液的目的是 。
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你设计的实验方案是 。(用实验中所提供的几种试剂)。
(4)对于H2O2分解反应,Fe2(SO4)3溶液也有一定的催化作用。为比较Fe2(SO4)3和CuSO4溶液对H2O2分解的催化效果。某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:

如图所示,同学们分别从定性和定量角度进行了比较。
①定性分析:如图甲可通过观察 ,定性比较得出结论。
②定量分析:用图乙所示装置做对照试验,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是 。
(5)通过对上述实验过程的分析,在实验设计时,要考虑_________方法的应用。
(6分)某化学小组利用下图所示装置测定铜锌合金样品中锌的质量分数(图中固定装置已略去)探究过程如下:
1.连接实验装置并检查装置气密性
Ⅱ.向B中加入质量为m的铜锌合金粉末,由注射器A向B缓缓加入稀硫酸,待B中不再有气体产生气体时,夹紧弹簧夹,立即移出D中导管,准确读取并记录量筒内水的体积。
Ⅲ.经过滤等操作,准确称量并记录B中剩余固体物质的质量。
IV.该小组的甲同学根据反应前后B中固体物质的质量计算样品中锌的质量分数;乙同学认定量筒内测得水的体积
即为反应生成气体的体积,并利用该气体在常温下的密度,根据化学方程式进行相关计算,得到样品中锌的质量分数。请回答下列问题:
(1)Ⅲ中,正确的操作顺序是:过滤、 、 、称量。
(2)通过误差分析,化学小组发现乙同学所用数据不可靠。造成该数据不可靠的原因及其对计算结果的影响是:
①II中,移出D中的导管内留存有水,导致计算结果偏小。
② 。
(3)①日常生活中为方便使用通常将金属制成合金,伍角币为钢芯镀铜、一元币为钢芯镀镍(Ni)合金①铸造以上硬币用到的材料都是 材料
②选择铸造硬币的材料不需要考虑的因素是 (填序号)。
| A.金属的导电性 | B.金属的耐腐蚀性 |
| C.金属的硬度 | D.金属价格与硬币面值的吻合度 |
Ni+ H2SO4=" Ni" SO4+ H2↑ Fe+ Ni Cl 2=" Ni" + Fe Cl 2
四种金属活动性由强到弱的顺序为 (用元素符号表示)。
(8分)小丽对家中的家用制氧机产生了浓厚的兴趣。她通过阅读说明书了解到家用制氧机的工作原理如下:
加压时,装填在制氧机内部的分子筛吸附空气中的氮气,制取高浓度氧气。减压时,分子筛将所吸附的氮气排放。整个过程中,分子筛并不消耗。
小丽用这台家用制氧机制取并收集了一袋气体,带到实验室对其进行研究。
实验I:小丽欲通过以下实验验证所收集的气体是否为纯净的氧气。
【实验记录】
| 实验步骤 | 实验现象 | 化学方程式 |
| 取一只250 mL的集气瓶,用排水法收集一瓶所带气体,然后把一小块燃着的木炭插入集气瓶中 | 木炭燃烧得更旺 | 化学方程式I |
【实验结论】收集的气体是纯净的氧气。
【实验反思】老师指出上述实验并不能证明小丽所带来的气体一定是纯净的氧气。该实
验不能证明所收集气体为纯净氧气的原因是 。
实验II:测定小丽所带气体中氧气的含量。
同学们在老师的指导下设计了如下图所示装置,进行实验,并重复多次。

(250 mL 集气瓶)
【实验记录】
| 实验操作 | 主要实验现象 | 实验结论及解释 | |
| ① | 检查装置的气密性 | | 装置的气密性良好 |
| ② | 加入药品,将装置连接固定 | | |
| ③ | 打开止水夹a和b,向A中缓慢鼓入一定量气体后关闭止水夹a和b | A中水进入到B中,B中水的体积为200 mL。 | 收集200 mL气体(由压强差引起的误差忽略不计) |
| ④ | 用凸透镜聚光引燃白磷 | 燃烧,产生大量白烟 | |
| ⑤ | 待白磷熄灭并冷却到室温, 进行操作I | 现象I | 小丽收集的气体不是纯净的氧气 |
【数据记录】
| 实验次序 | 1 | 2 | 3 | 4 | 5 |
| B中剩余水体积/mL | 100 | 42 | 39 | 41 | 38 |
【实验反思】
(1)这台家用制氧机制氧气的过程发生的变化属于 (填“物理变化”或“化学变化”)。
(2)导致第1组数据产生较大误差的可能原因是 。
(7分)小明在网络中看到镁是航空工业的重要材料,欲通过实验探究镁的性质。
(1)小明推测镁能与O2反应、与稀盐酸反应、与硫酸铜溶液反应,他的依据是 。
(2)小明设计了如下实验对假设进行验证。
①取一支试管,放入一根镁条,加入一定量稀盐酸,观察到有无色气体产生,发生反应的化学方程式为 。将镁条换为铁丝,重复上述操作,可观察到产生气体的速率 (填“变快”、“变慢”或“不变”)。
②另取一支试管,放入一根镁条,加入一定量硫酸铜溶液,观察到镁条表面有少量气泡产生,且有黑色物质生成。
(3)镁条与硫酸铜溶液反应的现象让小明感到困惑,他去图书馆查到相关资料:
资料1:硫酸铜溶液在配制时加入了少量硫酸;
资料2:当金属粉末颗粒很小时,容易成为黑色;
资料3:实验过程中发生了一系列复杂的反应,生成的黑色粉末可能是CuO、Cu
中的一种或两种。
①镁条与硫酸铜溶液反应的实验中产生的气体可能为 。
②小明进一步设计实验确定黑色粉末的成分,请在下表中补全实验方案。
| 实验操作 | 实验现象 | 结论 |
| 将黑色粉末过滤、晾干后,分成两份 | | |
| 将其中一份装入硬质玻璃管中,向其中通入CO后,加热,并将生成的气体通入澄清石灰水中 | 澄清石灰水 变浑浊 | 结论I |
| 将另一份置于坩埚中,称其质量为m1,在空气中加热一段时间后冷却,称其质量为m2。 | 现象I | 黑色粉末中含Cu |
(6分)下图所示的一组实验可用于研究燃烧的条件(夹持固定装置略去)。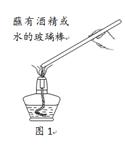
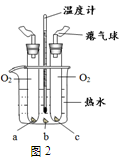
已知白磷的着火点为40℃,红磷的着火点为240℃。
(1)在如图1所示的实验中,分别用玻璃棒蘸取酒精和水,再在酒精灯火焰上加热,片刻后移开,实验现象如下:
| 实验用品 | 现象 |
| 蘸有酒精的玻璃棒 | 产生火焰 |
| 蘸有水的玻璃棒 | 无明显变化 |
(2)在如图2所示的实验中,a、b两处放有少量白磷,c处放有少量红磷,当看到a处白磷燃烧、c处红磷不燃烧时,估计温度计示数一定在 ℃以上,此现象能够说明燃烧应具备的条件是 。
(3)除上述两个条件外,燃烧还应具备的条件是 ;在图2所示的实验中,能说明该条件的实验现象是 。