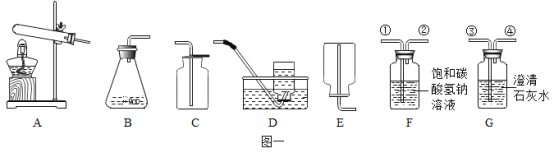
【题目】学习盐酸的化学性质后,小娟做如下实验:
(实验探究)
步骤 | 实验操作 | 实验现象 | 结论或解释 |
Ⅰ |
| 黑色固体完全溶解,溶液呈 _____色 | 盐酸与氧化铜发生了化学反应,方程式:_____ |
Ⅱ |
| 加入稀盐酸后,无明显现象;滴入酚酞,溶液变红 | 盐酸与氢氧化钠未发生化学反应 |
Ⅲ | 步骤Ⅰ、Ⅱ的废液混合
| 有沉淀生成,溶液仍为红色 | 氯化铜与氢氧化钠反应生成氢氧化铜沉淀和氯化钠所得溶液中溶质的成分_____(填序号) A 酚 酞、氢氧化钠 B 酚酞、氯化钠 C 酚酞、氢氧化钠、氯化钠 |
(实验反思)(1)小勇认为小娟实验步骤Ⅱ的结论不正确,小娟另取试管重新做了步骤Ⅱ的实验,滴入酚酞溶液变红色后,继续滴加稀盐酸,边滴边振荡。当观察到_____现象时(填字母),说明盐酸和氢氧化钠发生了反应。
A 溶液变成蓝色 B 溶液溶液红色恰好退去
(2)小娟将步骤Ⅲ烧杯中的溶液进行了过滤,并向所得溶液中加入_____再倒掉,以防止环境污染。
【题目】下表是 KNO3 和 Ca(OH)2 在不同温度时的溶解度。回答有关问题:
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | ||||||||
溶解度/g | KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 | |||||||
Ca(OH)2 | 0.19 | 0.17 | 0.16 | 0.14 | 0.13 | 0.11 | ||||||||
(1)两种物质中,溶解度随温度升高而减小的是_____,20℃时,硝酸钾的溶解度是_____
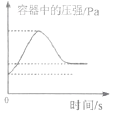
(2)60℃时,按图操作,A 中的溶液是_____(选填“饱和”或“不饱和”)溶液。C 中析出固体的质量是_____g。

(3)如图,向烧杯中加入一定量的硝酸铵固体,试管中氢氧化钙溶液的溶质质量分数_____(选填“变大”、“不变”或“变小”)。

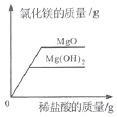
【题目】做完加热铜片的实验后,小明同学对其成分进行分析。取10g此样品,向其中分五次加入相同溶质质量分数的稀硫酸,使之充分反应,每次所用稀硫酸的质量及剩余固体的质量记录于下表:
第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
加入稀硫酸的质量/g | 20 | 20 | 20 | 20 | 20 |
充分反应后剩余固体的质量/g | 9.2 | 8.4 | 7.6 | 7 | 7 |
试回答下列问题:
(1)10g样品中氧化铜的质量为__________g。
(2)计算所加入稀硫酸中溶质的质量分数____________________。