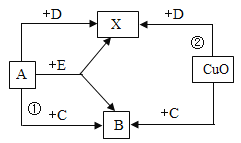
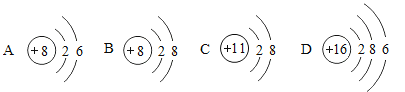【题目】为了探究金属与酸的反应,某兴趣小组进行了以下实验:
(1)A小组研究影响金属与酸反应剧烈程度的因素,如图时20℃时相同质量的铁粉、铁片、铝片分别与足量稀盐酸完全反应,产生氢气的质量与时间的关系图。
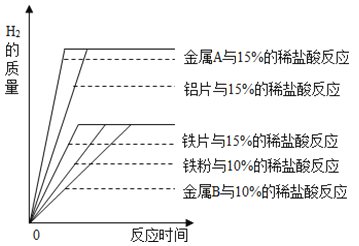
由此分析,归纳出影响金属与酸反应速率的因素有:金属的种类、_____和_____。
(2)金属铬(Cr)越来越受到人们的关注,B小组对Cr、Al、Cu的金属活动性顺序进行了探究,过程如下:
(提出假设)对三种金属的活动性顺序提出假设
a.Al>Cr>Cu b.Cr>Al>Cu c._____
(设计实验)同温下,取大小相同的金属薄片,分别投入到等体积、等浓度的足量稀盐酸中,观察现象,记录如下:
金属 | Cr | Al | Cu |
现象 | 反应缓慢,金属逐渐溶解 | 反应激烈,金属迅速溶解 | 无明显现象 |
(实验条件)实验前,打磨三种金属发生的是_____(填“物理”或“化学”)变化;上述实验使用等浓度的盐酸溶液的理由是_____。
(得出结论)原假设中正确的是_____(填假设中a、b或c),写出铬(铬与盐酸反应后显+2价)与盐酸反应的化学方程式_____。
【题目】甲同学为了区别氢氧化钠和氢氧化钙溶液,设计了如图所示的四组实验方案.

(1)其中能达到实验目的是 .
(2)在C组实验中发生的化学方程式为 .
(3)实验结束后,甲同学将A、C组四支试管中的溶液倒入同一容器中,看到溶液变浑浊,该现象说明有 物质生成(填化学式),滴入酚酞后溶液呈红色.
(4)滴入酚酞后溶液呈红色,说明溶液呈碱性.使溶液呈碱性的物质是什么呢?甲同学进一步推测:溶液中呈碱性的物质可能是碳酸钠、氢氧化钙和 三种物质中的一种,或是三种物质两两混合组成的混合物.
(5)为了验证推测,甲同学查阅资料,获悉氯化钡溶液呈中性,并设计如下实验加以验证.请根据要求完成下列空白:
实验内容 | 预测现象 | 结论 |
取少量容器中的上层溶液于试管中,加入过量的氯化钡溶液,静置 | ①若有白色沉淀,溶液呈无色 | 物质是碳酸钠 |
②若无沉淀生成,溶液呈红色 | 物质是氢氧化钙 | |
③若有白色沉淀,溶液呈红色 |
(6)乙同学认为甲同学第②步验证的结论不严密,原因是 .
【题目】Ⅰ.请你参与下列实验探究:

(问题情景)
在课外活动中,按照图1探究分子的运动时,闻到了刺激性的氨味。小兰在老师的指导下进行实验改进,图2为改进后装置,不再闻到刺激性气味,酚酞颜色变化更快速,得到了和图1相同的结论。
(查阅资料)
①氢氧化钠固体溶于水会放热;
②浓氨水越浓越易挥发,升高温度可以加快挥发;
③碳酸钠与稀硫酸反应会生成二氧化碳气体。
(实验探究与结论)
小兰用图2装置进行实验。滴入少量浓氨水后,湿润的酚酞滤纸条变红,从分子运动的角度分析,此现象可说明的结论是_______;
(思维拓展)
小超受小兰实验启发,进一步改装成图3装置,用于验证二氧化碳的性质。
(1)打开活塞K滴入稀硫酸后,两条用紫色石蕊试液润湿的试纸发生的变化是_______,以上两个变化验证的二氧化碳的性质是______、_______。
(2)小康认为对小超的实验进行简单改进,还可以同时验证:
①二氧化碳能使澄清石灰水变浑浊;
②二氧化碳不能燃烧,也不支持燃烧。
他的改进是:①_______ ②_______。
Ⅱ.某研究小组发现,超市里有一种污渍爆炸盐,能除去各种顽固污渍,其主要成分是过碳酸钠,化学式为Na2CO4,溶于水产生大量气泡。该小组同学决定探究该气体成分。
(猜想与假设)
小华:该气体可能是CO2、O2、CO、H2、N2。
小明:不可能含有N2,理由是______。
小芳:不可能含有CO和H2,因为从药品安全角度考虑,H2易燃易爆,CO具有___。
小组意见:该气体可能含有CO2、O2中的一种或两种。
(进行实验)
实验编号 | 实验操作 | 实验现象 |
① | 将气体通入澄清的石灰水中 | 澄清石灰水变浑浊 |
② | 将带火星的木条伸入该气体中 | 带火星的木条没有复燃 |
(得出结论)
(1)由实验①可知,该气体肯定含有______,写出①中发生反应的化学方程式______。
(2)由实验②______(填“能”或“不能”)确定该气体中不含氧气,理由是_______。
(3)为了进一步确定是否产生了O2,老师利用氧气传感器测得O2的浓度变化如图4所示,证明该气体中______(填“有”或“没有”)氧气。