【题目】学习金属的化学性质时,老师给同学们做了锌与稀硫酸反应制取氢气的实验。有同学问老师:可以用锌与浓硫酸反应来制取氢气吗?老师让同学们先去查资料,然后对锌与浓硫酸反应产生的气体进行探究
(提出问题)锌与浓硫酸完全反应产生的气体是什么?
(查阅资料)
(1)浓硫酸是强氧化性酸,能与多数金属(如Mg、Zn、Cu等)反应产生SO2。
锌与浓硫酸反应:![]()
(2)SO2是一种有刺激性气味的有毒气体,与CO2有相似的化学性质,与Ca(OH)2反应产生不溶于水的CaSO3(提出猜想)猜想1:只有SO2 猜想2:H2和SO2 猜想3:_____。
(实验探究)
同学们在老师指导下设计并进行如下图的实验:
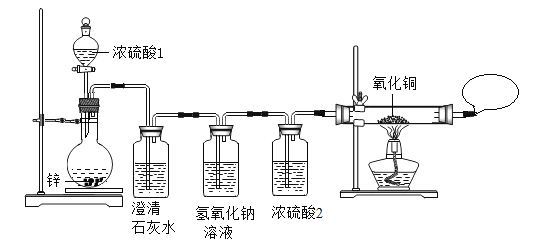
(现象与结论)
实验现象 | 实验结论 |
(1)_____。 | 有SO2产生。 |
(2)黑色的氧化铜变红色 | _____。 |
(得出结论)猜想_____正确。
(反思与拓展)
(1)实验中两处用了浓硫酸。浓硫酸2的作用是_____。
(2)有同学提出:实验进行到后阶段才能观察到黑色的氧化铜逐渐变红色。请解释实验开始阶段CuO处没有明显现象的原因:_____。
(3)实验室用金属与浓硫酸反应制取较纯的SO2气体,现有金属Zn和Cu最好选用金属_____理由是_____。
【题目】下列实验均来自初中课本,对其中实验现象的描述错误的是( )
测定空气中氧气的含量 |
镁条在空气中燃烧 |
一氧化碳与氧化铁反应 |
用肥皂水区分软水和硬水 |
A. 集气瓶内的水面上升约至刻度“1”处 | B. 产生耀眼白光,生成白色固体 | C. 玻璃管内红色粉末变为黑色 | D. 软水中无泡沫,硬水中有大量泡沫 |
A. A B. B C. C D. D
【题目】如图所示,把足量的硫粉放入氧气中充分燃烧。

(1)硫在氧气中燃烧的化学方程式是___________________________。
(2)实验后,取少量集气瓶内的溶液于试管中,再往试管中滴加数滴的紫色石蕊溶液,振荡。发现紫色石蕊溶液变成红色。(提示:石蕊溶液是将石蕊加入水中溶解后得到的混合物)
[提出问题]是什么物质使紫色石蕊变红色呢?
[提出假设]假设1:水使紫色石蕊变红;
假设2:__________________使紫色石蕊变红;
假设3:二氧化硫与水反应的生成物使紫色石蕊变红。
[设计实验]
①我们可判断假设________________不成立,因为石蕊溶液中含有这种物质,不能使紫色变红。
②请设计一个实验方案验证另外两个假设是否成立,用文字描述实验步骤及填写预期实验现象和结论。(提供的试剂和用品有:干燥的紫色石蕊纸花若干朵、干燥的二氧化硫两瓶、水)
实验步骤 | 预期实验现象和结论 |
将干燥的紫色石蕊纸花,放入盛有______________瓶中。 | _________________,假设2不成立。 |
将干燥的紫色石蕊纸花_______________后放入盛有干燥的二氧化硫的瓶中。 | ________________________,假设______________成立。 |