【题目】某兴趣小组利用海水(含 NaCl、MgCl2 和 CaCl2 等可溶性杂质及泥沙等难溶性杂质)和石灰石为原料制取漂白粉,流程如下:
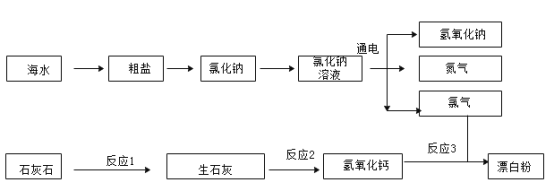
①海水暴晒得到粗盐,利用了氯化钠的溶解度随温度升高而______(选填“变大”、“变小”或“变化不大”)的 性质。
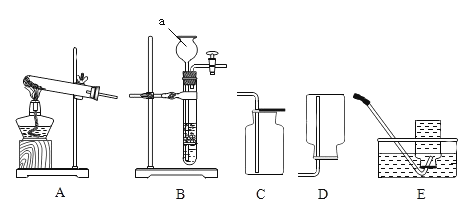
②粗盐提纯得到固体氯化钠,发生了______(填编号)。
A物理变化 B化学变化
③提纯操作中,过滤时用到了铁架台、烧杯、______(填仪器名称)。
④氯化钠溶液通电后发生的不是分解反应,判断的依据是______。
⑤反应1中的化学方程式______。
⑥设计实验方案证明石灰石已完全分解。
实验 | 现象 | 结论 |
______ | ________ | 石灰石已完全分解 |
⑦实际工业生产中,反应3化学方程式:2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2X,X 的化学式为______,Ca(ClO)2中氯元素的化合价为______,反应物氢氧化钙最好用______(填“饱和石灰水”或“石灰乳”)并不断搅拌。
【题目】利用坐标将元素的化合价与物质类别建立是化学学习的重要方法。

①a 处氢化物为天然气的主要成分,其燃烧的化学方程式_______。b处对应物质的类别是_______;盐对应的化学式中原子团的名称是_______。
②含碳物质在一定条件下可以相互转化。
化合价变化 | 相应的化学方程式 | 对应的用途 |
碳元素化合价升高 | _______ | _______ |
碳元素化合价不变 | _______ | 制汽水 |
碳元素化合价降低 | _______ | / |
③煤的主要成分是单质碳。用煤合成水煤气的反应微观示意图如下:

该反应中方框丁中微粒的图示为_______,说明乙物质具有_______性。
【题目】工业中合成SO3的反应:2SO2+O2![]() 2SO3。一定条件下,在一密闭容器内投入 SO2、O2、SO3、V2O5四种物质,在不同时刻测得各物质的质量(单位为 g)如下表所示。说法错误的是
2SO3。一定条件下,在一密闭容器内投入 SO2、O2、SO3、V2O5四种物质,在不同时刻测得各物质的质量(单位为 g)如下表所示。说法错误的是
甲 | 乙 | 丙 | 丁 | |
t1 | 100 | 5 | 80 | 5 |
t2 | 60 | 55 | a | b |
t3 | 40 | c | d | 5 |
A.丁物质一定是V2O5
B.d=15
C.丙物质是O2
D.t3时,生成乙75g