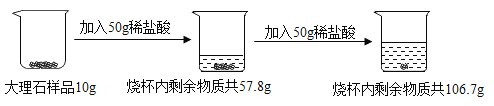
【题目】下列有关实验方案设计正确的是( )
选项 | 实验目的 | 实验方案 |
A | 配制6%的氯化钠溶液50g | 称取3g氯化钠固体于47mL蒸馏水中 |
B | 除去CaCl2溶液中的少量盐酸 | 加入适量的铁粉 |
C | 除去CO2中含有的少量CO | 点燃 |
D | 鉴别氢氧化钠溶液与澄清石灰水 | 分别取2~3mL未知溶液于试管中,再滴加紫色石蕊溶液 |
A.AB.BC.CD.D
【题目】 2020年1月25日总建筑面积为3.39万平方米的火神山医院正式开工,火神山医院在建造过程中用到了具有极好的抗冲击性和防潮性的HDPE膜。某化学兴趣小组对HDPE膜的组成元素产生了浓厚的兴趣,进行了如下探究。
[提出问题] HDPE膜由什么元素组成?
[查阅资料]①HDPE膜能够燃烧,燃烧可能生成一氧化碳: ②碱石灰主要成分是氢氧化钠固体和氧化钙固体。
[实验探究]如图所示,先通入干燥氮气,再将4.2g的HDPE膜样品在一定 质量的氧气中点燃,并将燃烧产物依次通过装置A、B、C、D (装置中每步反应均进行完全)。

[实验记录]
装置质量 | A装置总质量 | C装置总质量 |
实验前 | 100.0g | 100.0g |
实验后 | 105.4g | 113.2g |
[实验分析]
(1)实验前,先通入氮气的目的是___________________。
(2)装置A中浓硫酸的作用是___________________。
(3)实验中观察到装置B中黑色粉末变成红色,证明燃烧产物中有__________________(填化学式)。
(4)装置D的作用是___________________。
[数据处理] 4.2g的HDPE膜样品中含碳元素的质量为__________________g,含氢元素的质量为_________g。
[实验结论] HDPE膜由__________________元素组成。
[反思拓展]实验中的4.2g HDPE膜样品燃烧消耗的氧气质量为m,则m的取值范围为___________________。
【题目】氧化镁在医药等行业应用广泛。实验室以菱镁矿(主要成分为MgCO3,含少量FeCO3,其他杂质不溶于水和酸)为原料制备高纯氧化镁的实验流程如下:
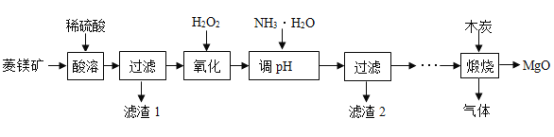
(1)为了提高“酸浸”的效果,可采取的措施有:适当升高温度、____________。MgCO3与稀硫酸反应的化学方程式为_________________。
(2)“氧化”过程中,将FeSO4全部转化为Fe2(SO4) 3,然后加氨水,调节溶液的PH范围为______________。(已知部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表)
对应离子 | Fe3+ | Fe2+ | Mg2+ |
开始沉淀时的pH | 2.7 | 7.9 | 9.4 |
完全沉淀时的pH | 3.7 | 9.6 | 11.4 |
(3)过滤后得到滤渣2和滤液,滤渣2是______(填化学式),此时滤液中的阳离子一定含有____________(填离子符号)。
(4)煅烧过程存在以下反应:![]() ;
;![]() ;
;![]()
已知:①硫在常温下是一种淡黄色固体,硫的熔点约为115.2°C,沸点约为444.7°C;②高锰酸钾溶液与SO2反应会褪色,且只吸收SO2,不吸收CO2;③碱溶液既吸收SO2,又吸收CO2。利用下图装置对煅烧产生的气体进行检验并收集。
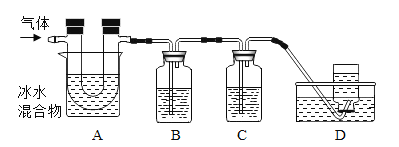
①集气瓶B中盛放的溶液是_______________(填字母),C中盛放的溶液是_____________(填字母)。
a Ca(OH)2溶液
b KMnO4溶液
c NaOH溶液
d BaCl2溶液
②装置D的作用是__________________________。
【题目】“微观-宏观-符号”三重表征是化学独特的表示物质及其变化的思维方法。
(1)下列是汽车尾气治理过程中有关化学反应的微观示意图。图中所示反应的化学方程式为___________________。

(2)某化学兴趣小组的同学探究了某些酸、碱、盐之间是否发生复分解反应。
内容 | 现象 | 实验解析 | 结论 | |
实验一 |
| ________ | 该反应的微观实质(用离子符号表示) :
| 复分解反应的实质是溶液中离子之间相互反应,生成__________ |
实验二 |
| 溶液颜色由红色恰好变为无色 |
| |
实验三 |
| 产生白色沉淀 | 该反应的微观实质(用离子符号表示) : ________ |
[迁移应用]下列离子在水中能大量共存,并形成无色溶液的是_______________(填字母)
a. Fe2+Na+NO3-Cl-
b. K+Na+OH- SO42-
c.H+K+SO42-OH-
d. Ba2+NO3-CO32-Cl-