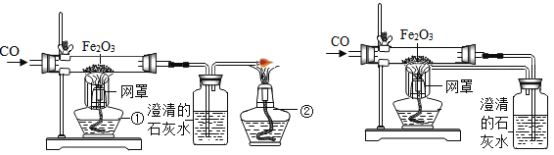
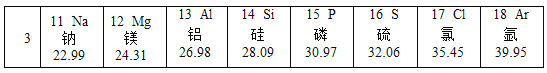
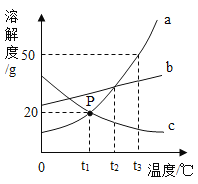
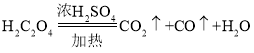【题目】某样品为铜和氧化铜的混合物,为测定样品中氧化铜的含量,甲、乙、丙、丁四位同学用同一样品分别进行实验,测定的实验数据如下表。请分析数据解答下列问题:
甲 | 乙 | 丙 | 丁 | |
所取固体样品的质量 | 25 | 25 | 20 | 20 |
加入硫酸溶液质量 | 50 | 100 | 100 | 120 |
反应剩余固体质量 | 21 | 17 | 12 | 12 |
(1)四位同学中, 同学所取的硫酸溶液质量不足(从“甲”、“乙”、“丙” 或“丁”中选择填写);
(2)混合物氧化铜的质量分数为?
(3)硫酸溶液中溶质的质量分数为?
【题目】已知 Na2CO3与 HCl 反应分两步进行:
第一步 Na2CO3与 HCl 反应生成 NaHCO3:![]() ;
;
第二步 NaHCO3 与 HCl 反应生成 CO2:![]() 。
。
现有这样一个实验:在两支试管中分别加入 3mL 稀盐酸,将两个各装有 0.3g NaHCO3 或 Na2CO3 粉末的小气球分别套在两支试管口,将气球内的NaHCO3或 Na2CO3 同时倒入试管中(反应中盐酸足量)。观察到现象如下:
(1)盛________的试管中产生气体的速率要快得多。
(2)盛_________的试管中气球变得更大,大小气球中生成气体的质量之比为(填最简单整数比)_____。
(3)甲同学用手触摸试管,发现盛 NaHCO3 粉末的试管变冷,而盛 Na2CO3的试管温度有升高。为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做 3 次平行实验,取平均值):
序号 | 试剂 1 | 试剂 2 | 混合前温度 | 混合后温度 |
① | 35mL 水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
② | 35mL 水 | 3.2 Na2CO3固体 | 20℃ | 24.3℃ |
③ | 35mL 稀盐酸 | 含2.5g NaHCO3的饱和溶液 32.5mL | 20℃ | 19℃ |
④ | 35mL 稀盐酸 | 含 3.2g Na2CO3的饱和溶液 23.1mL+10ml 水 | 20℃ | 24.2℃ |
⑤ | 35mL 稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 16.2℃ |
⑥ | 35mL 稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 25.1℃ |
通过上述实验可得出五条结论:
①NaHCO3 的溶解是__(吸热或放热)过程;
②Na2CO3 的溶解是____(吸热或放热)过程;
③NaHCO3 的饱和溶液和盐酸的反应是___(吸热或放热)反应;
④Na2CO3 的饱和溶液和盐酸的反应是____(吸热或放热)反应;
⑤NaHCO3 固体与稀盐酸反应的反应热是由_____(填①~⑤序号)的热效应之和。
【题目】许多在水溶液的反应(如复分解反应),往往有易溶物转化为难溶物或难溶物转化为更难溶物的现象。下表为相同温度下某些物质的溶解度:
物质 | AgCl (白色) | Ag2S (黑色) | CaSO4 (白色) | Ca(OH)2 (白色) | Ca(HCO3)2(白色) | CaCO3 (白色) | (NH4)2SO4 无色透明 |
溶解度/g | 1.5×10-4 | 1.3×10-6 | 0.2 | 0.165 | 16.6 | 0.0015 | 75.4 |
(1)若在含有氯化银固体的水中加入硫化钠溶液,可能发生的现象是 _________。
(2)生产硫酸铵化肥的方法之一是:把石膏(CaSO42H2O)粉悬浮于水中,不断通入氨气再通入二氧化碳,充分反应后,立即过滤,滤液经蒸发而得到硫酸铵晶体。该反应的化学方程式为_____。
(3)从上表中再寻找两种能够按照上述规律相互转化的物质,写出实现该转化的化学方程式:______ 。