【题目】同学们用碳酸钠溶液和盐酸的反应验证质量守恒定律,实验后他们对残留废液的成分进行探究。
[推理假设]
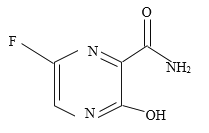
上述两种物质发生反应的化学方程式为_______,由此推测出废液中一定有NaCl,可能有_______。
[实验探究]
(1)确定废液中是否含有盐酸:
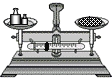
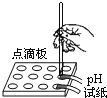
①选择试剂:根据盐酸的化学性质,同学们选用了如图所示的五种物质,其中物质x是酸碱指示剂中的_____溶液。
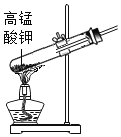
②实验验证:某同学向废液中加入少量的铁粉,观察到_____, 确定废液中一定没有盐酸。
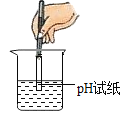
(2)确定废液中是否含有Na2CO3;某同学选用______测出废液的pH=10,确定废液中一定含有Na2CO3。
(3)处理废液,回收利用:欲从废液中得到纯净的NaCl,请完成如下实验方案设计。
方案 | 加入试剂 | 提纯的方法 | 方案评价 |
一 | 适量Ca(NO3)2溶液 | 过滤、 蒸发结晶 | ______(选填可行或不可行) |
二 | 稍过量的______ | ______ | 可行 |
(4)拓展运用:
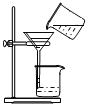
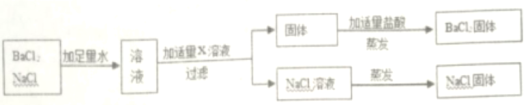
按如下图方案分离BaCl2和NaCl的固体混合物时,x溶液中溶质是_______。
【题目】小明在实验室发现一瓶氢氧化钠固体没有塞上瓶塞,于是他和他的同学一起对这瓶氢氧化钠固体展开探究,请你与他们一起进行探究.
【提出问题】这瓶氢氧化钠固体是否变质?
【查阅资料】CaCl2溶液呈中性.
【猜想与假设】①氢氧化钠没有变质;②该氢氧化钠部分变质;③该氢氧化钠 .
【设计实验】取氢氧化钠固体样品溶于水配成溶液A,进行如下实验:
实验步骤 | 实验现象 | 结论及解释 |
(1)取少量溶液A于试管中,向其中滴加足量的稀盐酸; | 有气泡产生 | 猜想 不成立 |
(2)另取少量溶液A于试管中,向其中滴加足量的氯化钙溶液; | 产生 | 反应的化学方程式为: |
(3)将步骤(2)所得的混合液静置,向上层清液中滴加无色的酚酞溶液. | 溶液呈红色 | 猜想 成立 |
【反思与交流】久置的氢氧化钠变质的原因是(用化学方程式表示) ,因此,氢氧化钠应 保存.
【探索与拓展】为进一步探究氢氧化钠的变质程度,小明称取18.6g氢氧化钠固体样品放入烧杯中,向其中逐滴加入稀盐酸,到不再产生气泡为止,共消耗稀盐酸100g,反应后称得烧杯中溶液的质量为114.2g.试计算:
(1)该样品中碳酸钠的质量为 ;
(2)该氢氧化钠的变质程度(即变质的氢氧化钠占变质前的氢氧化钠的质量分数)为 .