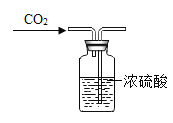
题目内容
【题目】(1)用下列物质的序号填空:
①碳酸钙 ②氢氧化钠 ③氧化钙 ④碳酸氢钠 ⑤熟石灰 ⑥稀盐酸
A常用作食品干燥剂的是___________;
B常用作补钙剂的是____________;
C可用于改良酸性土壤的是________;
D可用于金属表面除锈的是_________;
E常用作发酵粉和治疗胃酸过多的是___________;
F用于肥皂、石油、造纸、纺织、印染等工业的碱是___________。
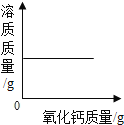
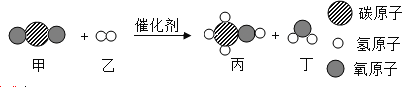
(2)硒被誉为“抗癌大王”。根据下图提供的有关硒的信息填空:
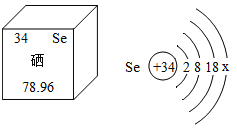
硒(Se)属于_________(填“金属”或 “非金属”) 元素, 其相对原子质量为__________,在化学反应中, 硒原子容易_________(填“得到”或“失去”)电子形成硒离子________(写离子符号)。
【答案】③ ① ⑤ ⑥ ④ ② 非金属 79.90 得到 Se2-
【解析】
(1)A、氧化钙能与水反应产生氢氧化钙,常用作食品干燥剂的是:③氧化钙;
B、骨骼中主要含有碳酸钙,碳酸钙中含有钙元素,常用作补钙剂的是:①碳酸钙;
C、氢氧化钙属于微溶物,其水溶液显碱性,可用于改良酸性土壤的是:⑤熟石灰;
D、稀盐酸能与氧化铁反应产生氯化铁溶液,可用于金属表面除锈的是:⑥稀盐酸;
E、碳酸氢钠能与稀盐酸反应产生氯化钠溶液、二氧化碳和水,且碳酸氢钠加热分解生成二氧化碳,故常用作发酵粉和治疗胃酸过多的是④碳酸氢钠;
F、氢氧化钠是重要的化工原料,用于肥皂、石油、造纸、纺织、印染等工业的碱是②氢氧化钠。
(2)硒(Se)不带“钅”字旁,属于非金属元素; 其相对原子质量为78.96,硒原子最外层电子数=34-2-8-18=6,在化学反应中, 硒原子容易得到2个电子形成硒离子:Se2-。

 寒假大串联黄山书社系列答案
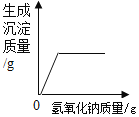
寒假大串联黄山书社系列答案【题目】实验课上,同学们发现一瓶久置的氢氧化钠固体的瓶口有白色粉末。在老师指导下,同学们对该白色粉末的成分进行了探究。
(猜想与假设)猜想Ⅰ:白色粉末是碳酸钠
猜想Ⅱ:白色粉末是氢氧化钠
猜想Ⅲ:白色粉末是__________________________________。
(查阅资料)CaCl2溶液,Ca(NO3)2溶液呈中性。
(实验探究)取白色粉末溶于水形成溶液A,设计如下实验:
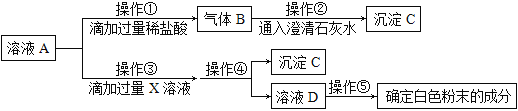
(1)由上述实验可知,猜想_______肯定不成立,沉淀C的化学式__________________。
(2)操作①产生气体的化学反应方程式是:_______________________________________。
(3)操作③的X溶液不能用以下的_______________(填字母序号)。
A CaCl2溶液 B Ca(OH)2溶液 C Ba(OH)2溶液 D Ca(NO3)2溶液
(4)操作④的名称___________________________。
(5)请写出操作⑤的实验如下:
方案 | 现象 | 结论 |
方案一:吸取少量溶液D滴入白色点滴板的孔穴中,再滴加无色酚酞试液 | _______________________ | 猜想Ⅰ成立 |
方案二:在洁净的玻璃片上放一片pH试纸,用 _____________________________滴在pH试纸上,将试纸显示的颜色与标准比色卡比较,读出pH。 | pH>7 | 猜想____成立 |
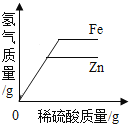
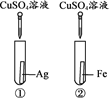
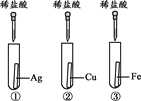
【题目】为探究铁、铜、银三种金属的活动性顺序,设计了A、B两个方案。
方案A | 方案B |
|
|
(1)能验证三种金属活动性顺序的方案是________(填“A”或“B”)。
(2)方案B中,证明铁的活动性比铜强的现象是___________。