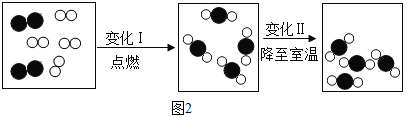
【题目】某化学兴趣小组同学学习了解碱盐的知识后,到实验室做碳酸钠与盐酸反应的实验。
小华实验:取![]() 溶液于试管中,再用胶头滴管滴入少量稀盐酸,无明显现象;
溶液于试管中,再用胶头滴管滴入少量稀盐酸,无明显现象;
小红实验:取2mL稀盐酸于试管中,再用胶头滴管滴入少量![]() 溶液,马上观察到有气泡产生。两人实验所用的
溶液,马上观察到有气泡产生。两人实验所用的![]() 溶液、稀盐酸均相同,却观察到不同的实验现象,他们为查明原因,进行了以下探究。
溶液、稀盐酸均相同,却观察到不同的实验现象,他们为查明原因,进行了以下探究。
(查阅资料)
①盐酸和![]() 溶液反应是分步进行的,即:反应1:
溶液反应是分步进行的,即:反应1:![]() 先
先![]() ;反应2:
;反应2:![]() 后
后![]()
②![]() 溶液与石灰水混合会变浑浊
溶液与石灰水混合会变浑浊
③![]() 可溶于水
可溶于水
(提出问题)小华实验没有观察到气体产生,是否只发生了“反应1”呢?
(思考分析)要证明只发生了“反应1”,需要证明![]() 的存在,若只发生了“反应1”,则小华实验后的溶液中除了有
的存在,若只发生了“反应1”,则小华实验后的溶液中除了有![]() 和NaCl,还可能有过量的
和NaCl,还可能有过量的![]() ,而
,而![]() 对
对![]() 的检验是有干扰的,设计实验时要考虑排除这个物质的干扰。
的检验是有干扰的,设计实验时要考虑排除这个物质的干扰。
(预计实验)
实验操作 | 现象预期 | 实验目的及反应方程式 |
步骤1:取少量小华实验后的溶液于试管中, ______ | 如果溶液中有 | 验证是否含有 |
步骤2 ______ | 如果小华实验后的溶液中有 | 证明 |
(交流反思)小红实验与小华实验有不同现象的原因是______。
【题目】下列除杂所选用试制与操作方法均正确的是
选项 | 物质 | 除杂试剂及操作 |
A |
| 加水溶解、过滤、蒸发结晶 |
B |
| 加入过量稀盐酸,蒸发结晶 |
C |
| 加入过量 |
D |
| 通入灼热的CuO |
A.AB.BC.CD.D
【题目】某兴趣小组在实验室用金属和酸反应来比较铝和锌的金属活动性大小,他们将一块铝片和一块相同质量的锌粒分别放入相同浓度的稀硫酸和稀盐酸中,发现开始时锌粒产生的气体更快,对照金属活动性顺序表,铝排在锌的前面,应该铝更快,为什么会出现这种情况呢?请你一起参与以下探究。
[提出问题]除了“金属活动性、溶液的质量、溶质质量分数”外,还有哪些因素会造成锌比铝产生气体快?
[猜想与假设]猜想1:锌与铝表面的氧化物;
猜想2:酸的种类;
猜想3:温度
[实验探究] (1)按题中开始时小组同学设计的实验方案比较锌、铝的金属活动性是____________(填“合理”或“不合理” )的,原因是_______________________。
(2)请写出铝与稀盐酸反应的化学方程式_______________________。
(3)某同学设计如下实验方案进行实验:
实验步骤 | 实验现象 | 实验结论 |
取表面积相同的锌、铝,分别放入温度相同、浓度相同、体积相同的稀盐酸中 | 锌产生气体快,铝刚开始反应比锌慢,后逐渐快起来 | 猜想1__________( 填“成立"或“不成立”) |
产生这种现象的原因是______________,所以做金属与酸的反应实验时,必要的处理是___________。
[实验拓展]再写一种影响铝与酸反应快慢的因素__________________ (与以上题中提到的影响因素不同),设计合理的实验方案,并写出“实验步骤、现象和结论”。