【题目】某化学兴趣小组为了分析生铁中铁的含量,进行了实验研究,即取60g经粉碎后的生铁,把800稀硫酸分4次加入到该样品中,测得数据记录如下表:
第1次 | 第2次 | 第3次 | 第4次 | |
加入稀硫酸质量(g) | 200 | 200 | 200 | 200 |
剩余固体质量(g) | 37.6 | 15.2 | 4 | 4 |
(说明:生铁中杂质不溶于水,也不与硫酸反应.)
(1)第2次测得剩余固体质量为15.2g,其成分为_____.
A 铁 B 铁和碳 C 碳
(2)生铁中铁的质量分数为多少?(写出计算过程,结果保留到小数点后一位)_____
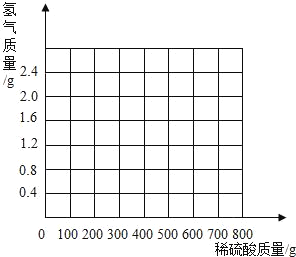
(3)计算所用稀硫酸的溶质质量分数为多少?_____(写出计算过程,结果保留到小数点后一位)并画出反应生成的氢气质量与加入稀硫酸质量的关系图._____
【题目】某学习小组对用碳酸盐可以制取CO2进行如下研究:
(1)向盛有等质量块状纯碱固体和块状碳酸钙固体的两装置中同时分别加入足量的相同质量相同浓度的稀盐酸,测得生成的CO2质量与时间关系如下表.
生成CO2质量/g | 2 | 4 | 6 | 8 | 12 | |
时间/s | 块状碳酸钙固体 | 10 | 25 | 40 | 60 | 85 |
块状纯碱晶体 | 4 | 9 | 15 | 25 | 40 | |
①从表中数据获得信息_____.
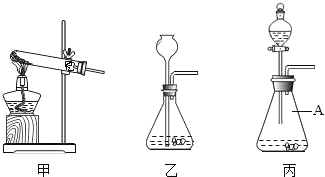
②如图是一组实验装置,该实验除用到电子秤外,还需用图中_____装置(填所选装置编号).
③实验中小红同学用沾有紫色石蕊试液的玻璃棒放在所选装 置的导管口检验生成的气体,观察到的现象为_____,由此她认为产生的气体为CO2.小军同学认为小红同学的验证不严密,理由是_____.
④请写出块状碳酸钙固体与稀盐酸反应方程式为_____.
⑤由上表数据可知,若用块状纯碱晶体代替块状石灰石制取CO2,为保证实验时间接近,所用稀盐酸质量分数需_____(选填“变大”、“变小”或“不变”).
(2)若需制取较纯净的CO2,则最好选择下列哪组药品?_____,因为:_____.
A 块状石灰石与稀盐酸 B 块状石灰石与稀硫酸
C 块状纯碱晶体与稀盐酸 D 块状纯碱晶体与稀硫酸
(3)丙图中标号仪器A的名称为_____,用装置甲制取氧气的化学反应方程式为_____.
【题目】为探究催化剂对双氧水(H2O2)分解的催化效果,某研究小组做了如下实验:
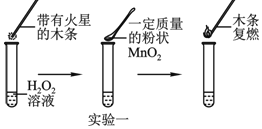
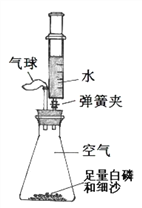
实验一:图中的实验能否证明MnO2是双氧水分解反应的催化剂?并说明理由______。
数据记录表
1%H2O2溶液(mL) | 50 | 50 | 50 |
加入MnO2的质量(g) | 0.1 | 0.2 | 0.4 |
测量40秒末得到O2体积(mL) |
实验二:从上面表格的设计可以看出,该实验的目的是______。
实验三:学习了催化剂知识后,某化学探究小组开始了“寻找新的催化剂”研究性实验:
(提出问题)氧化铁能否作过氧化氢溶液分解的催化剂?如果能,其催化效果如何?
(实验探究)
实验步骤 | 实验现象 |
I.分别量取5mL5%过氧化氢溶液放入A、B两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象。 | A试管中产生气泡,带火星木条复燃,B试管中无明显现象 |
II.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象。 | 试管中均产生气泡,带火星木条均复燃 |
III.将实验II中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag. | |
IV分别量取5mL5%过氧化氢溶液放入C、D两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象。 |
(实验结论)
(1)A中产生的气体是______;
(2)实验II.III证明:氧化铁的______和______在反应前后均没有发生变化,可以作过氧化氢分解的催化剂;
(3)写出氧化铁催化过氧化氢分解的文字表达式______。
(实验评价)
(4)实验设计IV的目的是______;
(5)若实验IV观察到D试管中产生气泡的速率更快,由此你可以得到的结论是:______。