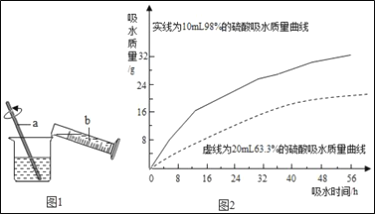
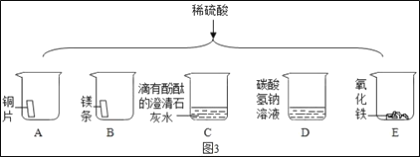
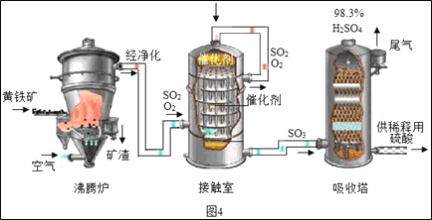
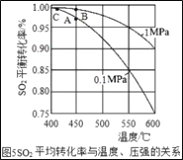
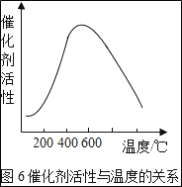
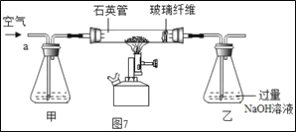
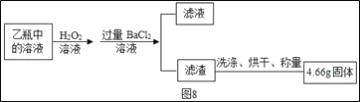
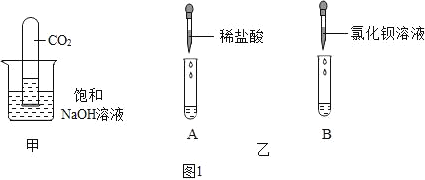
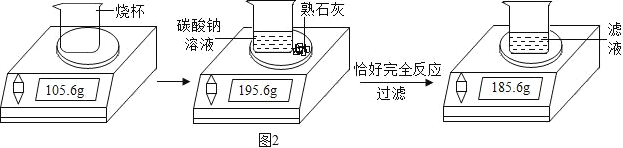
0 205471 205479 205485 205489 205495 205497 205501 205507 205509 205515 205521 205525 205527 205531 205537 205539 205545 205549 205551 205555 205557 205561 205563 205565 205566 205567 205569 205570 205571 205573 205575 205579 205581 205585 205587 205591 205597 205599 205605 205609 205611 205615 205621 205627 205629 205635 205639 205641 205647 205651 205657 205665 211419