【题目】下表列出了KNO3与NaCl在不同温度时的溶解度:
温度(℃) | 0 | 10 | 20 | 40 | 60 | 80 | 100 |
KNO3的溶解度(g) | 13.3 | 20.9 | 31.6 | 63.9 | 110 | 169 | 246 |
NaCl的溶解度(g) | 35.7 | 35.8 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
(1)KNO3和NaCl的溶解度相等的温度(t)范围是_____。
(2)现有含123gKNO3与17.9gNaCl的混合物,某同学设计了以下实验除去KNO3中的NaCl(操作过程中不考虑额外的水损失)。方法一:①向混合物中加入适量水,加热溶解;②继续加热溶液至100℃并恒温蒸发浓缩;③将溶液降温至10℃,仅得到KNO3晶体,过滤,将所得KNO3晶体洗涤并干燥。方法二:将混合物用饱和KNO3溶液反复浸洗,然后过滤。其中说法不正确的是_____。
A 方法一中除去KNO3中少量NaCl的主要方法是蒸发结晶
B 步骤③中,最多可得到KNO3晶体112.55g
C 方法二中浸洗前后,溶液中KNO3质量分数不变
D 步骤②中,为确保没有晶体析出,溶液中至少要保留50g水
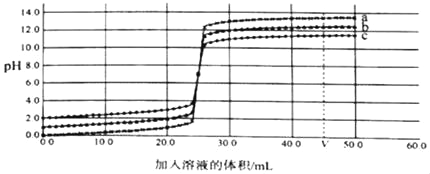
(3)80℃时将一定质量的KNO3或NaCl溶液按图示进行操作,得到四杯溶液(蒸发过程为恒温蒸发):
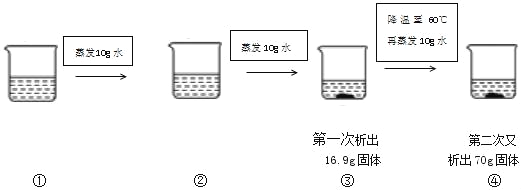
该溶液为_____(填KNO3或NaCl)溶液,烧杯①中的溶质质量为_____g。
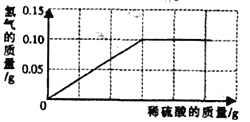
【题目】小宇为了测定实验室中氯酸钾样品的纯度,取10g样品与1g二氧化锰混合,依次加热该混合物t1、t2、t3、t4时间后,分别冷却称量剩余固体质量,记录的有关数据如下表(样品中的杂质不参与化学反应)
加热时间 | t1 | t2 | t3 | t4 |
剩余固体质量(g) | 9.68 | 9.04 | 7.16 | 7.16 |
试计算:
(1)完全反应后产生的氧气的总质量为_____________g;
(2)样品中氯酸钾的纯度是____(写出计算过程)
(3)加热时间t1后,9.68g剩余固体中除杂质外还含有的物质为_____________。
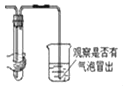
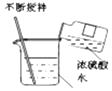
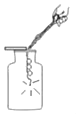
【题目】小昊同学欲通过化学实验验证“质量守恒定律”,进行了下列实验探究。
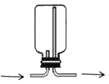
(实验设计)根据实验目的,小昊确定以“铁和硫酸铜溶液”为研究对象,设计的实验装罝如图二所示。

(进行实验)
实验步骤 | 实验现象与记录 | 解释或结论 |
①调零 |
| 如图一所示,调节平衡螺母天平无法平衡的原因是 _________; |
②称量铁钉的质量 | 记录称量数据为5.6g |
|
③称量硫酸铜溶液和烧杯的总质量 | 记录称量数据为113.2g |
|
④铁钉放入盛有硫酸铜溶液的烧杯中 | _____________________________________________ | 该反应的化学方程式为__________________________; |
⑤充分反应后,按如图二方式放好仪器和药品并称量 | 记录称量数据为_____________ | 该反应遵守质量守恒定律 |
(交流反思)(1)下列物质的溶液可以替代硫酸铜溶液直接利用图二装置完成上述实验的是______(填序号)。 A.硫酸铝 B.稀硫酸 C.硝酸银 D.乙醇
(2)实验结束后,过滤步骤⑤烧杯中的混合物,洗涤和干燥后称量固体的质量为5.8g,则该实验中生成铜的质量为___________g。