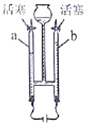
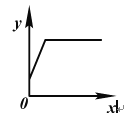
【题目】向一定量某固体中逐滴加入某溶液至过量,x轴表示加入溶液的质量。下列选项中y轴表示的含义与所给图像变化趋势一致的是( )
选项 | 固体 | 溶液 | y轴含义 |
A | 二氧化锰 | 过氧化氢溶液 | 水的质量 |
B | 铁粉和铜粉 | 硫酸铜溶液 | 所得溶液中硫酸铜的质量 |
C | 大理石(杂质不参加反应) | 稀盐酸 | 固体中杂质的质量分数 |
D | 氯化钠和碳酸氢钠混合物 | 稀盐酸 | 二氧化碳的体积 |
A. A B. B C. C D. D
【题目】同学们对H2O2溶液分解的反应速率的影响因素进行探究。
实验1:探究H2O2溶液浓度、温度对反应速率的影响
(实验方案)在一定温度下,向相同质量的H2O2溶液中加入相同质量的MnO2粉末,测量收集150 mL O2所需的时间。
实验序号 | H2O2溶液的浓度/% | 温度/℃ | 时间/s |
I | 30 | 20 | 待测 |
II | 15 | 30 | 待测 |
III | a | b | 待测 |
实验2:依据下图装置进行实验(部分仪器略去),探究催化剂种类对反应速率的影响
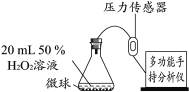
用相同粒数的MnO2、CuO、Fe2O3、Cr2O3四种催化剂微球(质量相等、表面积相同),分别进行实验,锥形瓶内压强随时间的变化如下图。

(解释与结论)
(1)实验1中反应的化学方程式是______。若要制得3.2 gO2,需要H2O2的质量为______g。
(2)为了达到实验1的目的,补全实验方案。
① 若a与b不相等,则a=______;b=______。
② 若a与b相等,则设计实验I、III的目的是______。
(3)实验2中使用相同粒数催化剂微球的原因是______。
(4)通过对实验2数据的分析,可得出的结论是______。
(反思与评价)
(5)实验1是通过测量收集等体积O2所需时间来比较H2O2溶液的反应速率,还可以通过测量______来比较H2O2溶液的反应速率。