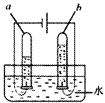
【题目】某同学设计如表所示实验,探究金属铜对过氧化氢溶液分解速率的影响.
操作 | 装置 | 现象 |
1、取一小块铜丝网,卷成筒形,固定在铜丝上. |
| |
2、分别向①和②中注入15mL30%的过氧化氢溶液,并放入盛有热水的③中. |
| 约1分钟后可观察到①和②中都有少量气泡产生 |
3、把铜丝插入①中. |
| ①中有大量气泡产生,约分钟后不再有气泡产生;此时②中 仍然有少量气泡产生 |
回答下列问题:
(1)试管②在实验中的作用是________;
(2)根据上述实验,可以得出的结论是____________________________;
(3)用本实验探究铜是不是过氧化氢分解的催化剂,需要对上述方案进行补充,其中必要的是_____、______.
A.称量实验前铜丝网的质量B.将实验后的铜丝网干燥、称重
C.向仪器中加入二氧化锰 D.将实验后的铜丝网干燥、粉碎
【题目】某同学为了测定氯酸钾样品中氯酸钾的质量分数,取2.5 g该样品与0.5 g二氧化锰混合,加热该混合物(假设杂质不参加反应),称量剩余固体质量,分4次记录如下表:
第一次 | 第二次 | 第三次 | 第四次 | |
加热时间 | T1 | T2 | T3 | T4 |
剩余固体的质量(g) | 2.88 | 2.48 | 2.08 | 2.04 |
(1)不再进行第五次实验记录的原因是________________________。
(2)完全反应后产生氧气的质量________g。
(3)该样品中氯酸钾的质量分数是多少______?(要求:写出计算过程)
【题目】小婧同学学习化学后知道,镁在氧气中燃烧会生成白色的氧化镁固体。但她在空气中点燃镁条时,却发现在生成的白色固体中还夹杂着少量的淡黄色固体。
[提出问题]为什么会生成淡黄色固体?
[查阅资料]小婧查阅资料,记录了下列几种物质的颜色:
物 质 | MgO | MgCl2 | Mg3N2 | Mg(NO3)2 | MgCO3 | Mg(OH)2 |
颜 色 | 白色 | 白色 | 淡黄色 | 白色 | 白色 | 白色 |
其他同学认为不必查阅氯化镁的颜色,理由是___________________________;
同时小婧还查阅到:镁可以在CO2中燃烧,生成氧化镁和一种黑色固体。你认为黑色固体是________
[提出猜想]分析资料,小婧认为淡黄色固体可能是由镁与空气中的______反应生成的;
[实验探究]小婧设计实验证实了自己的猜想,她的方案可能是________________;
[实验结论]根据小婧的实验结果,写出镁条在空气中燃烧时两个反应的化学方程式:_________ 、_____
[反思与评价]通过上述实验和有关资料,你对燃烧及灭火有什么新的认识?(写出2点)____________、_________________。