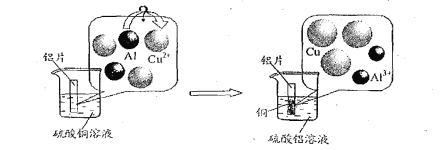
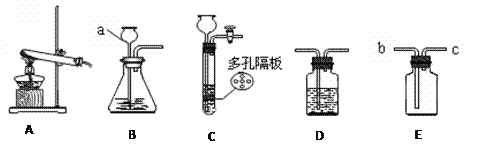
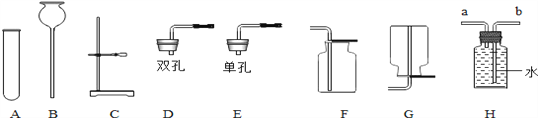
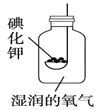
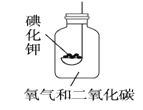
0 202887 202895 202901 202905 202911 202913 202917 202923 202925 202931 202937 202941 202943 202947 202953 202955 202961 202965 202967 202971 202973 202977 202979 202981 202982 202983 202985 202986 202987 202989 202991 202995 202997 203001 203003 203007 203013 203015 203021 203025 203027 203031 203037 203043 203045 203051 203055 203057 203063 203067 203073 203081 211419