在密闭容器中,有甲、乙、丙、丁四种物质在一定条件下充分反应,并测得反应前后各物质的质量如表所示:下列说法错误的是()
物 质 | 甲 | 乙 | 丙 | 丁 |
反应前质量/g | 10 | 4 | 30 | 22 |
反应后质量/g | 待测 | 13 | 38 | 5 |
A. 反应后甲的质量为0g
B. 甲可能是该反应的催化剂
C. 乙、丙变化的质量比为9:8
D. 该反应是分解反应
A 【解析】A、根据反应前后物质的总质量不变,反应后甲的质量=10g+4g+30g+22g?13g?38g?5g=10g,反应后甲的质量是10g,错误;B、甲的质量反应前后没有变化,可能没有参加反应,也可能是催化剂。正确;C、乙的质量增加了(13g-4g)=9g;丙的增加质量为(38g-301g)=8g,所以乙、丙的变化质量比为9:8,正确;D、反应后丁的质量减少,是反应物,乙、丙的质量增加...填写化学符号或化学符号表示的意义
化学符号 | ____ | _______ |
| NO3- | _______ | ||
表示意义 | 氖气 | 三个铁离子 | _______ | _______ | 2个氮气分子 |
通过对化学学习,相信你已经初步掌握了实验室制取气体的有关知识.请结合图示回答: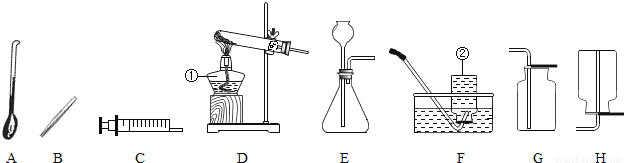
(1)写出图中标示的仪器名称:①___;②___
(2)甲KMnO4制取O2,应选用的发生装置为___(填字母序号,下同),收集装置可选用___(写一种即可);取用KMnO4为___色;写出该反应的化学方程式___.
(3)若用G装置收集氧气,检验氧气是否集满的方法是_____________________
(4)若乙同学用双氧水和二氧化锰来制取氧气,实验前为了控制反应速率,可选用___代替发生装置中某一仪器达到了实验目的实验结束后,乙同学想回收二氧化锰,可用___ (填实验操作名称)的方法分离出二氧化锰。该操作过程中需要用到的玻璃仪器主要有玻璃棒、烧杯和___,其中玻璃棒的作用是___.
(5)若收集气体丙时只能用装置G,则可推知气体丙的性质可能有___.
(6)化学反应速率是衡量化学反应进行快慢的物理量,为了探究影响化学反应速率的因素,以过氧化氢分解为研究对象进行实验。
三个小组均可采用如图装置进行实验,记录收集10mL氧气的时间,实验室可供选择的试剂有:2.5%、5%、10%三种浓度的H2O2溶液、MnO2、CuO、红砖粉末。
A组:探究催化剂对化学反应速率的影响
取5mL10%H2O2溶液,三次实验分别加入0.5gMnO2、红砖粉末、CuO进行实验,记录数据如下:
试剂 | MnO2 | 红砖粉末 | CuO |
t/s | 10 | 60 | 20 |
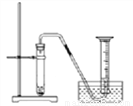
由此可出结论:MnO2、CuO对H2O2分解有催化作用,红砖粉末无催化作用,某同学对该结论提出疑问。
补充对比实验,操作为___.
结果:长时间(大于100s),收集到很少量气体。
更正结论:红砖粉末___(选填“有”、“无”)催化作用,三者中___催化效率最高。
B组:探究浓度对化学反应速率的影响
甲同学:取10mL5%H2O2溶液,加入0.5gMnO2为催化剂,进行实验,记录时间t1.
乙同学:取10mL2.5%H2O2溶液,加入0.5gMnO2为催化剂,进行实验,记录时间t2.
实验结果___.
结论:浓度越大,反应速率越快。
丙同学:对实验设计提出疑问,并补充实验___.
记录时间t3,且t1
更正结论为:当___时,反应物浓度越大,反应速率越快。
酒精灯 集气瓶 D F或G 紫黑色 2KMnO4K2MnO4+MnO2+O2↑ 带火星的木条放在集气瓶口,观察木条是否复燃 分液漏斗(注射器) 过滤 玻璃棒 引流 能溶于水且密度大于空气的性质取 取5mL10%H2O2溶液,记录数据 有 二氧化锰 t1
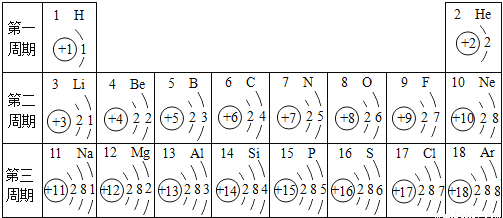
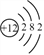 ,在化学反应中易___(填“得”或“失”)电子。
,在化学反应中易___(填“得”或“失”)电子。