15.NaCl 和KNO3在不同温度时的溶解度如下,下列说法错误的是( )
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
| A. | 30℃时,在100 g水里溶解45.8g KNO3时,溶液恰好达到饱和状态 | |
| B. | KNO3的溶解度大于NaCl的溶解度 | |
| C. | NaCl和KNO3的溶解度都随着温度的升高而增大 | |
| D. | NaCl 和KNO3溶解度相等时,温度t的范围在20℃~30℃之间 |
14.电工师傅使用的“验电笔“中常充入一种气体,此气体通电时会发出红光,它是( )
| A. | 氧气 | B. | 天然气 | C. | 空气 | D. | 氖气 |
13.化学与生活密切相关,下列淮南特产食物中,主要用来为人体提供糖类的是( )
| A. |  焦岗湖咸鸭蛋 | B. |  驻马店糯米 | C. |  八公山豆腐 | D. |  曹庵草莓 |
12.研究金属的腐蚀对资源的利用和保护意义重大.
(1)为了探究铁腐蚀的条件,进行如图(1)所示的实验,经过一周后观察:

通过实验发现:铁锈蚀是铁与水和氧气发生化学反应的过程.甲同学认为,试管A发生的现象能够说明这一点.乙同学不同意他的观点,认为必须全面观察试管ABC(选填试管编号)发生的现象,并经过科学严谨的推理,才能得出上述结论.
B中加入的蒸馏水要事先煮沸,其目的是排出溶解在水中的氧气.
(2)家中的刀具若沾有食盐水锈蚀更快.为了进一步探究影响铁锈蚀速率的因素,做了如下的实验.
【提出问题】铁锈蚀速率与哪些因素有关?
【查阅资料】
①物质溶解在水中得到的混合物称为水溶液,如氯化钠溶解在水中得到氯化钠溶液,乙醇溶解在水中得到乙醇溶液.
 ②氯化钠溶液能导电;乙醇溶液不能导电.
②氯化钠溶液能导电;乙醇溶液不能导电.
【猜想】
铁的锈蚀速率与下列因素有关:①反应时的温度;②氧气的含量;③水溶液的导电性.
【实验】
每次取两套如图(2)所示的装置,编号为I、II.向两套装置中分别装入质量、大小相同的铁钉和等体积的蒸馏水,进行如下三组对比实验(实验开始时,各瓶内气体压强保持一致).
(3)若将两根铁钉分别放入两支试管中,在一支试管中加入稀硫酸,另一支试管中加入稀盐酸,观察到两支试管内均有大量气泡产生,铁钉逐渐溶解,在酸溶液中被快速腐蚀.
【反思与提高】
①根据该探究实验以及你所学的知识,判断下列说法正确的是AC(填序号).
A.金属的腐蚀是指金属单质与其它物质发生化学反应的过程
B.金属越活泼,就越容易被锈蚀
C.金属腐蚀不一定要有氧气参加
②某同学向分别盛有等质量的铁粉和锌粒的试管中,导入等质量,等溶质质量分数的稀硫酸,以“金属表面产生气泡的快慢”为标准来判断两种金属的活动性强弱.有的同学认为这种方案不够合理,理由是等质量的铁粉和锌粒与稀硫酸的接触面积不同.
③将一定质量的铁粉放入硝酸铜、硝酸锌的混合溶液中,充分反应后过滤,所得固体中一定含有的物质是铜,且反应后溶液质量比反应前减小(选填“增大”“减小”或“不变”)
【拓展延伸】
(4)金属M长期露置于空气中,表面已经被锈蚀,经检测,锈蚀物中除含有M外,还含有C、H、O三种元素.根据质量守恒定律推测:
①使金属M锈蚀的物质中一定有H2O和CO2(填化学式,下同),可能有O2.
②小芳同学为了验证空气中的O2是否参加了反应,设计了如图(3)几个实验,你认为其中必须要做的实验是AE(填序号),说明:所用蒸馏水经煮沸迅速冷却;固体干燥剂只吸水且不与其他物质反应.

(1)为了探究铁腐蚀的条件,进行如图(1)所示的实验,经过一周后观察:

通过实验发现:铁锈蚀是铁与水和氧气发生化学反应的过程.甲同学认为,试管A发生的现象能够说明这一点.乙同学不同意他的观点,认为必须全面观察试管ABC(选填试管编号)发生的现象,并经过科学严谨的推理,才能得出上述结论.
B中加入的蒸馏水要事先煮沸,其目的是排出溶解在水中的氧气.
(2)家中的刀具若沾有食盐水锈蚀更快.为了进一步探究影响铁锈蚀速率的因素,做了如下的实验.
【提出问题】铁锈蚀速率与哪些因素有关?
【查阅资料】
①物质溶解在水中得到的混合物称为水溶液,如氯化钠溶解在水中得到氯化钠溶液,乙醇溶解在水中得到乙醇溶液.
 ②氯化钠溶液能导电;乙醇溶液不能导电.
②氯化钠溶液能导电;乙醇溶液不能导电.【猜想】
铁的锈蚀速率与下列因素有关:①反应时的温度;②氧气的含量;③水溶液的导电性.
【实验】
每次取两套如图(2)所示的装置,编号为I、II.向两套装置中分别装入质量、大小相同的铁钉和等体积的蒸馏水,进行如下三组对比实验(实验开始时,各瓶内气体压强保持一致).
| 影响因素 | 实验设计 | 实验现象 | 实验结论及解释 |
| ①温度 | 将装置I放入25℃恒温环境中,装置II放入40℃恒温环境中. | 两套装置中铁钉均锈蚀,且U型管中液面均由b处上升至a处,则所需时间I>II. | 锈蚀的速率I<II;铁的锈蚀速率与反应时的温度有关,温度越高,锈蚀速率越快. |
| ②氧气含量 | 在相同温度下,装置I中充满氧气,装置II中充满空气 | 两套装置中铁钉均锈蚀,且U型管中液面均由b处上升至a处,则所需时间I<II | 铁的锈蚀速率与氧气的含量有关,氧气的含量越多,铁的锈蚀越快. |
| ③水溶液的导电性 | 在相同温度下,装置I集气瓶中加入10mL氯化钠溶液;装置II集气瓶中加入10mL乙醇. | 两套装置中铁钉均锈蚀;且U型管中液面均由b处上升至a处,则所需时间I<II. | 铁的锈蚀速率与溶液是否导电有关,溶液导电性越强,铁的锈蚀速率越快 |
【反思与提高】
①根据该探究实验以及你所学的知识,判断下列说法正确的是AC(填序号).
A.金属的腐蚀是指金属单质与其它物质发生化学反应的过程
B.金属越活泼,就越容易被锈蚀
C.金属腐蚀不一定要有氧气参加
②某同学向分别盛有等质量的铁粉和锌粒的试管中,导入等质量,等溶质质量分数的稀硫酸,以“金属表面产生气泡的快慢”为标准来判断两种金属的活动性强弱.有的同学认为这种方案不够合理,理由是等质量的铁粉和锌粒与稀硫酸的接触面积不同.
③将一定质量的铁粉放入硝酸铜、硝酸锌的混合溶液中,充分反应后过滤,所得固体中一定含有的物质是铜,且反应后溶液质量比反应前减小(选填“增大”“减小”或“不变”)
【拓展延伸】
(4)金属M长期露置于空气中,表面已经被锈蚀,经检测,锈蚀物中除含有M外,还含有C、H、O三种元素.根据质量守恒定律推测:
①使金属M锈蚀的物质中一定有H2O和CO2(填化学式,下同),可能有O2.
②小芳同学为了验证空气中的O2是否参加了反应,设计了如图(3)几个实验,你认为其中必须要做的实验是AE(填序号),说明:所用蒸馏水经煮沸迅速冷却;固体干燥剂只吸水且不与其他物质反应.

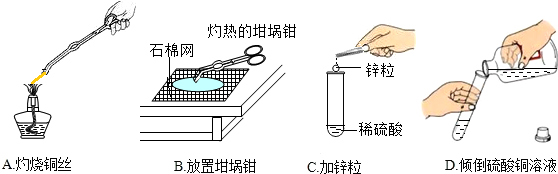
10.下列实验方案能达到探究目的是 ( )

0 168523 168531 168537 168541 168547 168549 168553 168559 168561 168567 168573 168577 168579 168583 168589 168591 168597 168601 168603 168607 168609 168613 168615 168617 168618 168619 168621 168622 168623 168625 168627 168631 168633 168637 168639 168643 168649 168651 168657 168661 168663 168667 168673 168679 168681 168687 168691 168693 168699 168703 168709 168717 211419

| A. | ①③⑤⑥ | B. | ②③④⑤ | C. | ①②④⑤ | D. | ④⑤ |

 【猜想与假设】
【猜想与假设】