4.在“空气中氧气含量的测定”实验探究中,
①甲同学设计了如图1的实验方案:在集气瓶内放足量红磷,塞紧橡皮塞,用放大镜聚集太阳光来引燃红磷,待红磷火焰熄灭且集气瓶冷却至室温后,打开止水夹.如果实验成功,那实验过程中观察到的主要现象有产生大量白烟、水倒吸入集气瓶约占$\frac{1}{5}$体积.
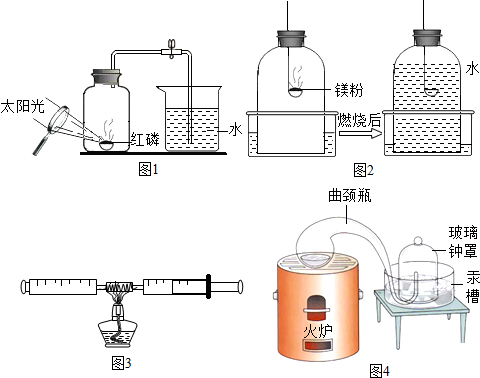
②乙同学设计了如图2的实验方案:将足量镁粉点燃后放入钟罩装置进行实验,写出镁粉与氧气反应的化学方程式2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO.燃烧完毕冷却后水几乎占满整个钟罩,已知镁是一种很活泼的金属,请推测产生这一现象的可能原因镁不仅和氧气反应,还与氮气发生反应.如果将图2中镁粉换成碳粉进行相同实验,则不能 (能或不能)用来测定空气中氧气的含量.
③丙同学设计了如图3的实验方案:反应容器是由两个针筒和中间的玻璃管组成的密闭系统,容器内留有30mL空气.加热等铜丝的温度升高后,交替缓缓推动两个注射器活塞,观察到亮红色的铜丝表面覆盖着一层黑色物质(反应方程式:2Cu+O2 $\stackrel{△}{→}$ 2CuO),实验数据记录如下:
Ⅰ.反应后容器内气体体积X理论上为24mL.
Ⅱ.如果反应结束后测得容器内气体体积为28mL,假设装置气密性完好,那造成实验有误差的原因可能是铜丝过少 (试举一个即可).
④十八世纪法国化学家拉瓦锡为了研究空气的组成设计的实验如图4,实验原理是汞与氧气在加热条件下会反应生成红色的氧化汞粉末.当年拉瓦锡在观察到汞表面浮起红色渣滓后,还继续加热了12天才停止实验,他这样做的理由是为了保证把装置内的氧气全部反应完.
①甲同学设计了如图1的实验方案:在集气瓶内放足量红磷,塞紧橡皮塞,用放大镜聚集太阳光来引燃红磷,待红磷火焰熄灭且集气瓶冷却至室温后,打开止水夹.如果实验成功,那实验过程中观察到的主要现象有产生大量白烟、水倒吸入集气瓶约占$\frac{1}{5}$体积.

②乙同学设计了如图2的实验方案:将足量镁粉点燃后放入钟罩装置进行实验,写出镁粉与氧气反应的化学方程式2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO.燃烧完毕冷却后水几乎占满整个钟罩,已知镁是一种很活泼的金属,请推测产生这一现象的可能原因镁不仅和氧气反应,还与氮气发生反应.如果将图2中镁粉换成碳粉进行相同实验,则不能 (能或不能)用来测定空气中氧气的含量.
③丙同学设计了如图3的实验方案:反应容器是由两个针筒和中间的玻璃管组成的密闭系统,容器内留有30mL空气.加热等铜丝的温度升高后,交替缓缓推动两个注射器活塞,观察到亮红色的铜丝表面覆盖着一层黑色物质(反应方程式:2Cu+O2 $\stackrel{△}{→}$ 2CuO),实验数据记录如下:
| 反应前容器内空气体积 | 反应后容器内气体体积 |
| 30mL | X mL |
Ⅱ.如果反应结束后测得容器内气体体积为28mL,假设装置气密性完好,那造成实验有误差的原因可能是铜丝过少 (试举一个即可).
④十八世纪法国化学家拉瓦锡为了研究空气的组成设计的实验如图4,实验原理是汞与氧气在加热条件下会反应生成红色的氧化汞粉末.当年拉瓦锡在观察到汞表面浮起红色渣滓后,还继续加热了12天才停止实验,他这样做的理由是为了保证把装置内的氧气全部反应完.
19.下列实验操作中,“先”与“后”的顺序正确的是( )
| A. | 制备气体,先装药品,后检查装置的气密性 | |
| B. | 用胶头滴管取用试剂,先挤瘪胶头排出空气,后伸入试剂中吸取试剂 | |
| C. | 用排水法收集完气体,先停止加热,后把导管移出水槽 | |
| D. | 检查反应容器的气密性,先用两只手捂住容器的外壁,后将导管一端浸入水中 |
18.关于化学反应C+O2$\stackrel{点燃}{→}$CO2的理解错误的是( )
| A. | 碳发生了氧化反应 | |
| B. | 碳与纯氧发生反应,会发出明亮的白光 | |
| C. | 每1mol碳和1mol氧气点燃后反应生成1mol二氧化碳 | |
| D. | 每1g碳和1g氧气反应生成2g二氧化碳 |
17.图示“错误操作”与图下面“可能产生的后果”不一致的是( )
| A. |  试剂粘附在试管壁上 | B. |  引起中毒 | ||
| C. |  液体会冲出试管 | D. |  读数不准确 |
16.铁在氧气中燃烧的现象描述错误的是( )
| A. | 产生大量的热 | B. | 生成黑色固体 | C. | 火星四射 | D. | 产生白烟 |
15.关于地壳中含量最多的元素所形成的单质,以下说法正确的是( )
0 168412 168420 168426 168430 168436 168438 168442 168448 168450 168456 168462 168466 168468 168472 168478 168480 168486 168490 168492 168496 168498 168502 168504 168506 168507 168508 168510 168511 168512 168514 168516 168520 168522 168526 168528 168532 168538 168540 168546 168550 168552 168556 168562 168568 168570 168576 168580 168582 168588 168592 168598 168606 211419
| A. | 常温下为固态 | B. | 在空气中含量也最多 | ||
| C. | 可用作燃料 | D. | 元素以游离态存在 |
 、
、 、
、 分别代表氢原子、氧原子和碳原子.
分别代表氢原子、氧原子和碳原子.

