10.下列说法中,不利于保护金属资源的是( )
0 164450 164458 164464 164468 164474 164476 164480 164486 164488 164494 164500 164504 164506 164510 164516 164518 164524 164528 164530 164534 164536 164540 164542 164544 164545 164546 164548 164549 164550 164552 164554 164558 164560 164564 164566 164570 164576 164578 164584 164588 164590 164594 164600 164606 164608 164614 164618 164620 164626 164630 164636 164644 211419
| A. | 在铁制品表面刷漆 | B. | 将废旧电池随意丢弃 | ||
| C. | 回收铝制饮料罐 | D. | 用塑料代替合金制造汽车部件 |
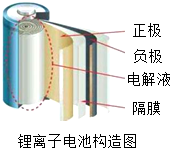 阅读下面科普短文.
阅读下面科普短文. 金属在生活中应用广泛.
金属在生活中应用广泛.
 “合理膳食,均衡营养”会让我们更健康.
“合理膳食,均衡营养”会让我们更健康.
