12. “双吸剂”是一种常见袋装食品的保鲜剂,能吸收空气中的氧气,二氧化碳、水蒸气等.化学兴趣小组的同学在某食品袋中发现一包“双吸剂”,其标签如图所示.同学们对这包久置的“双吸剂”固体样品很好奇,设计实验进行探究.
“双吸剂”是一种常见袋装食品的保鲜剂,能吸收空气中的氧气,二氧化碳、水蒸气等.化学兴趣小组的同学在某食品袋中发现一包“双吸剂”,其标签如图所示.同学们对这包久置的“双吸剂”固体样品很好奇,设计实验进行探究.
【提出问题】久置“双吸剂”固体的成分是什么?
【查阅资料】
①铁与氯化铁溶液在常温下发生反应生成氯化亚铁.Fe+2FeCl3═3FeCl2
②碱性的Na2CO3溶液可以和中性的CaCl2溶液发生复分解反应.
【作出猜想】久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3
【实验探究1】下表是小明设计的实验方案和记录的实验报告,请你补充完整:
【实验质疑】
小组同学通过讨论认为实验中并不能得出一定含Fe2O3的结论,理由是Fe2O3+6HCl═2FeCl3+3H2O;Fe+2FeCl3=3FeCl2(用化学方程式表示).
为进一步确定这包久置的“双吸剂”固体的成分进行如下定量试验.
【实验探究2】取3g样品研碎,并用磁铁充分吸引后,得到剩余固体2.6g,按照如图流程进行实验,请回答相关问题:

(1)操作二、操作三名称是过滤;
(2)固体Ⅰ的成分是CaCO3和Fe2O3(填物质化学式,下同);
(3)烧杯A中溶液和加入的碳酸钠溶液反应化学方程式为Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
(4)依据实验探究1,2中现象的分析及数据计算判断,这包久置“双吸剂”固体的成分是Fe、Fe2O3、CaO、Ca(OH)2、CaCO3.
【实验反思】
下列对实验探究1、2的反思,不正确的是D(填字母序号).
A.对物质成分的探究有时需要定性与定量实验的结合
B.实验探究2烧杯C中的溶质为Na2CO3和NaOH
C.实验探究1、2中都有气体产生,但生成的气体成分不同
D.在原样品中加入足量盐酸有4个反应发生.
 “双吸剂”是一种常见袋装食品的保鲜剂,能吸收空气中的氧气,二氧化碳、水蒸气等.化学兴趣小组的同学在某食品袋中发现一包“双吸剂”,其标签如图所示.同学们对这包久置的“双吸剂”固体样品很好奇,设计实验进行探究.
“双吸剂”是一种常见袋装食品的保鲜剂,能吸收空气中的氧气,二氧化碳、水蒸气等.化学兴趣小组的同学在某食品袋中发现一包“双吸剂”,其标签如图所示.同学们对这包久置的“双吸剂”固体样品很好奇,设计实验进行探究.【提出问题】久置“双吸剂”固体的成分是什么?
【查阅资料】
①铁与氯化铁溶液在常温下发生反应生成氯化亚铁.Fe+2FeCl3═3FeCl2
②碱性的Na2CO3溶液可以和中性的CaCl2溶液发生复分解反应.
【作出猜想】久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3
【实验探究1】下表是小明设计的实验方案和记录的实验报告,请你补充完整:
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量固体放于试管中,滴加一定量的稀盐酸,用带导管的单孔橡皮塞塞紧试管口,导管另一端伸入澄清石灰水中. | 试管中固体逐渐减少,有大量无色气体产生,得到浅绿色溶液,澄清的石灰水变浑浊. | 样品中一定含有Fe和CaCO3,不含Fe2O3 |
| ②取少量样品放入试管中,加水溶解,静置后取上层清液滴加无色酚酞试液. | 试管底部有不溶物,上层清液由无色变为红色 | 样品中含有氧化钙或氢氧化钙或二者都有 |
小组同学通过讨论认为实验中并不能得出一定含Fe2O3的结论,理由是Fe2O3+6HCl═2FeCl3+3H2O;Fe+2FeCl3=3FeCl2(用化学方程式表示).
为进一步确定这包久置的“双吸剂”固体的成分进行如下定量试验.
【实验探究2】取3g样品研碎,并用磁铁充分吸引后,得到剩余固体2.6g,按照如图流程进行实验,请回答相关问题:

(1)操作二、操作三名称是过滤;
(2)固体Ⅰ的成分是CaCO3和Fe2O3(填物质化学式,下同);
(3)烧杯A中溶液和加入的碳酸钠溶液反应化学方程式为Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
(4)依据实验探究1,2中现象的分析及数据计算判断,这包久置“双吸剂”固体的成分是Fe、Fe2O3、CaO、Ca(OH)2、CaCO3.
【实验反思】
下列对实验探究1、2的反思,不正确的是D(填字母序号).
A.对物质成分的探究有时需要定性与定量实验的结合
B.实验探究2烧杯C中的溶质为Na2CO3和NaOH
C.实验探究1、2中都有气体产生,但生成的气体成分不同
D.在原样品中加入足量盐酸有4个反应发生.
11.实验设计是化学实验的重要环节.请根据下列实验要求回答相关问题:
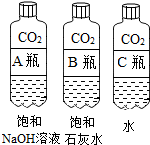
【活动与探究一】用对比实验方法探究二氧化碳的性质.
(1)实验一中振荡3个矿泉水塑料瓶,观察到塑料瓶变瘪的程度为A>B>C,其中变浑浊的瓶内发生反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O;对比A瓶与C(填“B”或“C”)瓶的实验现象,可证明CO2能与NaOH发生反应.
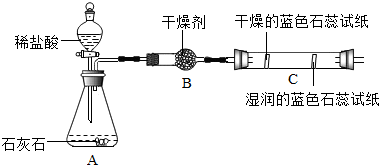
(2)实验二观察到C装置中发生的现象是干燥的石蕊试纸无变化,湿润的蓝色石蕊试纸变红色,结论是CO2+H2O=H2CO3(用化学方程式表示).
【活动与探究二】用变量控制方法探究影响物质溶解性的因素.
(3)实验三目的是探究温度对硝酸钾溶解性的影响;实验四是探究溶剂种类对物质溶解性的影响,该实验中需要控制的变量是温度和溶质、溶剂的质量相等.
【活动与探究三】定量测定空气中氧气的含量.
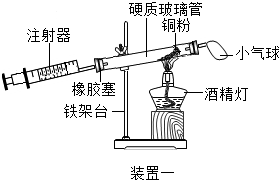
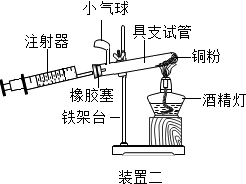
(4)实验五中,反应的原理为2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO(用化学方程式表示);装置一比装置二更合理,理由是装置一中氧气反应的更充分;
根据下表提供的实验数据,完成下表:
定量实验操作中易产生误差,如果反应前气球中存在气体(其量小于注射器内的空气),而实验后冷却至室温,将气球内的气体全部挤出读数,导致实验测得结果偏小(填“偏小”、“偏大”或“无影响”).
【活动与探究一】用对比实验方法探究二氧化碳的性质.
| 实验一 | 实验二 |
 |  |
(2)实验二观察到C装置中发生的现象是干燥的石蕊试纸无变化,湿润的蓝色石蕊试纸变红色,结论是CO2+H2O=H2CO3(用化学方程式表示).
【活动与探究二】用变量控制方法探究影响物质溶解性的因素.
| 实验三 | 实验四 |
 |  |
【活动与探究三】定量测定空气中氧气的含量.
| 实验五 | |
 |  |
根据下表提供的实验数据,完成下表:
| 硬质玻璃管中空气的体积 | 反应前注射器中空气体积 | 反应后注射器中气体体积 | 实验测得空气中氧气的体积分数 |
| 30mL | 20mL | 12mL | 16% |
9. 食盐在生产和生活中具有广泛的用途,是一种重要的资源,海水中储量很丰富.
食盐在生产和生活中具有广泛的用途,是一种重要的资源,海水中储量很丰富.
(1)海水晒盐的原理是利用阳光和风蒸发水分,使海水中的水分蒸发掉,使氯化钠结晶出来;
(2)晒盐过程中得到粗盐和卤水.卤水的主要成分及其溶解度的变化如图.t2℃时,MgCl2的溶解度为100g;将t2℃时MgCl2、KCl和MgSO4三种物质的饱和溶液分别降温至t1℃时,析出的晶体是MgCl2、KCl(填物质化学式);
(3)将纯净的氯化钠固体配制成溶液,20℃时,向4个盛有50g水的烧杯中,分别加入一定质量的氯化钠并充分溶解.4组实验数据如下表:
若将②中得到的溶液稀释成质量分数为0.9%的生理盐水,需加水的质量是941g.
关于上述实验的叙述不正确的是D(填序号).
A.①②所得溶液是该温度下的不饱和溶液
B.③④所得溶液溶质的质量分数相等
C.20℃时,氯化钠的溶解度为36g
D.20℃时,将④恒温蒸发25g水,过滤得18g固体.
 食盐在生产和生活中具有广泛的用途,是一种重要的资源,海水中储量很丰富.
食盐在生产和生活中具有广泛的用途,是一种重要的资源,海水中储量很丰富.(1)海水晒盐的原理是利用阳光和风蒸发水分,使海水中的水分蒸发掉,使氯化钠结晶出来;
(2)晒盐过程中得到粗盐和卤水.卤水的主要成分及其溶解度的变化如图.t2℃时,MgCl2的溶解度为100g;将t2℃时MgCl2、KCl和MgSO4三种物质的饱和溶液分别降温至t1℃时,析出的晶体是MgCl2、KCl(填物质化学式);
(3)将纯净的氯化钠固体配制成溶液,20℃时,向4个盛有50g水的烧杯中,分别加入一定质量的氯化钠并充分溶解.4组实验数据如下表:
| 实验序号 | ① | ② | ③ | ④ |
| 加入氯化钠的质量/g | 4.5 | 9 | 18 | 20 |
| 溶液质量/g | 54.5 | 59 | 68 | 68 |
关于上述实验的叙述不正确的是D(填序号).
A.①②所得溶液是该温度下的不饱和溶液
B.③④所得溶液溶质的质量分数相等
C.20℃时,氯化钠的溶解度为36g
D.20℃时,将④恒温蒸发25g水,过滤得18g固体.
7. 向一定质量AgNO3和Cu(NO3)2的混合溶液中加入过量的Zn粉,溶液质量随反应时间变化的情况如图所示.下列说法正确的是( )
向一定质量AgNO3和Cu(NO3)2的混合溶液中加入过量的Zn粉,溶液质量随反应时间变化的情况如图所示.下列说法正确的是( )
 向一定质量AgNO3和Cu(NO3)2的混合溶液中加入过量的Zn粉,溶液质量随反应时间变化的情况如图所示.下列说法正确的是( )
向一定质量AgNO3和Cu(NO3)2的混合溶液中加入过量的Zn粉,溶液质量随反应时间变化的情况如图所示.下列说法正确的是( )| A. | 取a点溶液,滴加稀盐酸,无白色沉淀 | |
| B. | 图标上b-c段质量增加的原因是Zn与Cu(NO3)2溶液反应 | |
| C. | b点时溶液中金属离子有Zn2+、Cu2+,金属单质有Zn、Cu、Ag | |
| D. | c点和d点溶质种类不同,金属单质种类也不同 |
6.下列是分析久置空气中的NaOH固体的相关实验(不考虑水分),其中合理的是( )
| 序号 | 实验目的 | 实验方案 |
| ① | 证明变质 | 取少量固体,加水溶解,滴加足量稀盐酸,观察是否有气泡产生 |
| ② | 确定成分 | 取少量固体,加入石灰水,过滤,向滤液中滴加酚酞试液 |
| ③ | 测定纯度 | 取a g样品与足量氯化钡溶液充分反应,将沉淀过滤、洗涤、干燥,得到m g固体 |
| ④ | 除去杂质 | 取固体,加水溶解,滴加氯化钙溶液至恰好完全反应,过滤 |
| A. | ①② | B. | ①③ | C. | ②④ | D. | ③④ |
5. 地壳中含有的氧、硅、铝、铁.结合如图分析,关于这四种元素的说法正确的是(
地壳中含有的氧、硅、铝、铁.结合如图分析,关于这四种元素的说法正确的是(
 地壳中含有的氧、硅、铝、铁.结合如图分析,关于这四种元素的说法正确的是(
地壳中含有的氧、硅、铝、铁.结合如图分析,关于这四种元素的说法正确的是(| A. | 氧原子核电荷数为8 | |
| B. | 硅元素属于金属元素 | |
| C. | 铝元素和氧元素形成化合物的化学式为Al3O2 | |
| D. | 铁的相对原子质量为55.85g |
4.下列化学符号中数字“2”表示的意义不正确的是( )
| A. | 2NH4+:二个铵根离子 | |
| B. | H2O:一个水分子中含有一个氢分子 | |
| C. | Mg2+:一个镁离子带二个单位的正电荷 | |
| D. | $\stackrel{+2}{Cu}$O:氧化铜中铜元素的化合价为正二价 |
3.2015年我国计划发射4颗北斗三期实验卫星,对全球导航中的新技术进行验证.发射卫星的火箭常用的燃料是肼(N2H4),反应的化学方程式为:2N2H4+N2O4$\frac{\underline{\;点燃\;}}{\;}$3X+4H2O,则X的化学式是( )
0 164140 164148 164154 164158 164164 164166 164170 164176 164178 164184 164190 164194 164196 164200 164206 164208 164214 164218 164220 164224 164226 164230 164232 164234 164235 164236 164238 164239 164240 164242 164244 164248 164250 164254 164256 164260 164266 164268 164274 164278 164280 164284 164290 164296 164298 164304 164308 164310 164316 164320 164326 164334 211419
| A. | N2 | B. | NO3 | C. | NO | D. | HNO3 |






