10.制作糕点常用Na2CO3或NaHCO3作膨松剂,我校化学兴趣小组的同学根据Na2CO3和NaHCO3的性质进行了一系列探究.
【查阅资料】
(1)溶解度比较:
(2)已知碳酸氢钠在270℃左右就能分解为碳酸钠、水和二氧化碳,而碳酸钠受热不分解.
(3)常温下,浓度相同的Na2 CO3溶液比NaHCO3溶液的碱性强.
【探究一】NaHCO3和Na2CO溶解度差异的探究.
小方同学分别取xg两种固体粉末加入20℃10g水中充分溶解,通过观察现象区分出碳酸钠和碳酸氢钠,x可能是A.
A.2 B.0.96 C.0.5 D.3
【探究二】Na2CO3和NaHCO3鉴别探究
【猜想与假设】
(1)甲同学认为可用澄清石灰水鉴别Na2CO3和NaHCO3溶液.
(3)乙同学认为固体Na2CO3、NaHCO3可用加热的方法鉴别.
【实验探究】(1)甲同学在两支分别盛有少量Na2CO3、NaHCO3溶液的试管中,各加入澄清石灰水,观察到两支试管中的现象相同,均产生了白色沉淀,实验结果与猜想不一致,即不能用澄清石灰水鉴别Na2CO3和NaHCO3溶液.
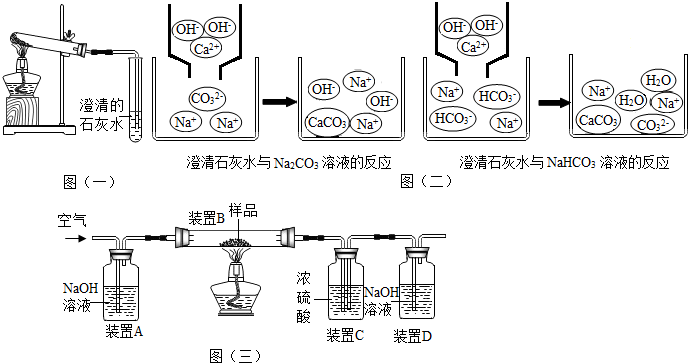
(3)乙同学分别取了一定量的Na2CO3、NaHCO3固体于大试管中加热(如图(一)所示):①加热Na2CO3时,开始即见小试管中有少量气泡产生,继续加热,气泡逐渐减少,未见澄清石灰水变浑浊,
②加热NaHCO3时,丙同学观察到实验现象与①不同,证实了自己的猜想是合理的.
【问题讨论】
(1)小组同学对上述实验展开了讨论,对甲同学的两个实验进行了比较,并从物质在溶液中解离出不同离子的微观角度分析了原因(如图(二)1、图(二)2).请写出Na2CO3与澄清石灰水发生反应的化学方程式Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;写出NaHCO3与澄清石灰水混合时参与反应的离子:Ca2+、HC${{O}_{3}}^{-}$、OH+.
【探究三】测定某Na2CO3和NaHCO3混合物中NaHCO3的质量分数
【方案一】称取一定质量样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算.
(1)坩埚中发生反应的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(2)实验中,需加热至恒重的目的是保证NaHCO3全部分解.
【方案二】利用如图(三)装置进行实验,装置B中放有样品(整套装置气密性良好,各装置中气体吸收剂足量).
【实验步骤】
(1)检查装置的气密性;(2)称取样品10g,加到装置B中;(3)称量装置B、C、D的质量(含药品);(4)连接装置;(5)加热;(6)停止加热继续通入空气;(7)再次称量装置B、C、D的质量(含药品).【数据记录】
【问题回答】
①如图装置C的作用是吸收水蒸气,装置C中一个明显的错误是右侧导管伸入液面以下.
②实验过程中必须向装置内通入空气,装置A中发生反应的化学方程式为2NaOH+CO2=Na2CO3+H2O.若没有装置A,造成测定结果偏大(填“偏大”“不变”或“偏小”)
【讨论分析】
小红同学认为,表格中三组数据都可以计算该样品中NaHCO3的质量分数,但小张认为不能用C装置的质量变化来计算,其理由是装置A中逸出的水蒸气会进入装置C中;改进方法:在装置A、B之间增加一个浓硫酸的干燥装置.小王又认为用装置D的质量差会偏大而影响计算,应增加一个操作:连接D装置前,缓缓鼓入空气,目的是排尽装置内的二氧化碳气体.
【数据处理】经过反复讨论,大家一致赞成应该利用表格中的装置B的质量变化进行计算NaHCO3和Na2CO3混合物中NaHCO3的质量分数84%.
【拓展应用】固体Na2CO3中混有少量NaHCO3,可通过加热方法除去.
【查阅资料】
(1)溶解度比较:
| 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
| Na2CO3 | 12.5g | 21.5g | 39.7g | 49.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
(3)常温下,浓度相同的Na2 CO3溶液比NaHCO3溶液的碱性强.
【探究一】NaHCO3和Na2CO溶解度差异的探究.
小方同学分别取xg两种固体粉末加入20℃10g水中充分溶解,通过观察现象区分出碳酸钠和碳酸氢钠,x可能是A.
A.2 B.0.96 C.0.5 D.3
【探究二】Na2CO3和NaHCO3鉴别探究
【猜想与假设】
(1)甲同学认为可用澄清石灰水鉴别Na2CO3和NaHCO3溶液.
(3)乙同学认为固体Na2CO3、NaHCO3可用加热的方法鉴别.
【实验探究】(1)甲同学在两支分别盛有少量Na2CO3、NaHCO3溶液的试管中,各加入澄清石灰水,观察到两支试管中的现象相同,均产生了白色沉淀,实验结果与猜想不一致,即不能用澄清石灰水鉴别Na2CO3和NaHCO3溶液.
(3)乙同学分别取了一定量的Na2CO3、NaHCO3固体于大试管中加热(如图(一)所示):①加热Na2CO3时,开始即见小试管中有少量气泡产生,继续加热,气泡逐渐减少,未见澄清石灰水变浑浊,
②加热NaHCO3时,丙同学观察到实验现象与①不同,证实了自己的猜想是合理的.

【问题讨论】
(1)小组同学对上述实验展开了讨论,对甲同学的两个实验进行了比较,并从物质在溶液中解离出不同离子的微观角度分析了原因(如图(二)1、图(二)2).请写出Na2CO3与澄清石灰水发生反应的化学方程式Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;写出NaHCO3与澄清石灰水混合时参与反应的离子:Ca2+、HC${{O}_{3}}^{-}$、OH+.
【探究三】测定某Na2CO3和NaHCO3混合物中NaHCO3的质量分数
【方案一】称取一定质量样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算.
(1)坩埚中发生反应的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(2)实验中,需加热至恒重的目的是保证NaHCO3全部分解.
【方案二】利用如图(三)装置进行实验,装置B中放有样品(整套装置气密性良好,各装置中气体吸收剂足量).
【实验步骤】
(1)检查装置的气密性;(2)称取样品10g,加到装置B中;(3)称量装置B、C、D的质量(含药品);(4)连接装置;(5)加热;(6)停止加热继续通入空气;(7)再次称量装置B、C、D的质量(含药品).【数据记录】
| 装置B | 装置C | 装置D | |
| 实验前物质的质量/g | 180.0 | 200.0 | 122.2 |
| 实验后物质的质量/g | 176.9 | 201.5 | 124.8 |
①如图装置C的作用是吸收水蒸气,装置C中一个明显的错误是右侧导管伸入液面以下.
②实验过程中必须向装置内通入空气,装置A中发生反应的化学方程式为2NaOH+CO2=Na2CO3+H2O.若没有装置A,造成测定结果偏大(填“偏大”“不变”或“偏小”)
【讨论分析】
小红同学认为,表格中三组数据都可以计算该样品中NaHCO3的质量分数,但小张认为不能用C装置的质量变化来计算,其理由是装置A中逸出的水蒸气会进入装置C中;改进方法:在装置A、B之间增加一个浓硫酸的干燥装置.小王又认为用装置D的质量差会偏大而影响计算,应增加一个操作:连接D装置前,缓缓鼓入空气,目的是排尽装置内的二氧化碳气体.
【数据处理】经过反复讨论,大家一致赞成应该利用表格中的装置B的质量变化进行计算NaHCO3和Na2CO3混合物中NaHCO3的质量分数84%.
【拓展应用】固体Na2CO3中混有少量NaHCO3,可通过加热方法除去.
4.下列有关物质的鉴别、检验、除杂所用的试剂或方法正确的是( )
| 选项 | 实验目的 | 所用试剂或方法 |
| A | 鉴别氯化钠溶液和稀盐酸 | 无色酚酞 |
| B | 鉴别硫酸钠溶液和硝酸钾溶液 | 氯化钡溶液 |
| C | 除去氧化钙中的少量碳酸钙 | 加水溶解后过滤 |
| D | 除去二氧化碳中的HCl | 氢氧化钠溶液 |
| A. | A | B. | B | C. | C | D. | D |
3.运用推理、归纳、类比、对比的方法得出下列结论,其中合理的是( )
| A. | 铝的金属活动性比铁强,则铝制品比铁制品更容易锈蚀 | |
| B. | 水和过氧化氢的组成元素相同,则两者的化学性质相同 | |
| C. | 向某固体上滴加稀盐酸,有气泡产生,则该固体一定是碳酸盐 | |
| D. | 碱性溶液能使石蕊试液变蓝,所以能使石蕊试液变蓝的溶液呈碱性 |
2.2015年1月2日,哈尔滨一仓库发生大火,造成重大人员伤亡.下列生活中处理火灾事故的方法中正确的是( )
0 164101 164109 164115 164119 164125 164127 164131 164137 164139 164145 164151 164155 164157 164161 164167 164169 164175 164179 164181 164185 164187 164191 164193 164195 164196 164197 164199 164200 164201 164203 164205 164209 164211 164215 164217 164221 164227 164229 164235 164239 164241 164245 164251 164257 164259 164265 164269 164271 164277 164281 164287 164295 211419
| A. | 家用电器着火,用水扑灭 | |
| B. | 档案资料着火,可用液态二氧化碳扑灭 | |
| C. | 室内起火,迅速打开所有门窗通风 | |
| D. | 高层楼房失火时,要乘电梯迅速撤离 |
 2015年4月6日,福建漳州古雷腾龙芳烃PX项目联合装置区发生爆炸,造成严重污染,PX 是对二甲苯(p-xylene)的简写,其结构式如图,分子式为C6H4(CH3)2,它是一种透明液体,不溶于水,具有芳香气味,有毒,蒸汽可以和水蒸气混合形成爆炸性混合物,请根据所学回答如下问题:
2015年4月6日,福建漳州古雷腾龙芳烃PX项目联合装置区发生爆炸,造成严重污染,PX 是对二甲苯(p-xylene)的简写,其结构式如图,分子式为C6H4(CH3)2,它是一种透明液体,不溶于水,具有芳香气味,有毒,蒸汽可以和水蒸气混合形成爆炸性混合物,请根据所学回答如下问题: