12.区别稀盐酸和稀硫酸,最好选用( )
| A. | 紫色石蕊试液 | B. | 无色酚酞试液 | C. | AgNO3溶液 | D. | BaCl2溶液 |
11.下列物质发生化学反应时没有气体生成的是( )
| A. | 铁和稀硫酸 | B. | 碳酸钠和稀盐酸 | ||
| C. | 氢氧化钠和盐酸 | D. | 氯化铵和氢氧化钙 |
10.欲使含有盐酸的氯化钙溶液变成中性,不用指示剂,应该加入下列试剂中的( )
| A. | 纯碱 | B. | 生石灰 | C. | 石灰石 | D. | 熟石灰 |
9. 甲、乙两种固体物质的溶解度曲线如图所示.下列有关叙述中错误的是( )
甲、乙两种固体物质的溶解度曲线如图所示.下列有关叙述中错误的是( )
 甲、乙两种固体物质的溶解度曲线如图所示.下列有关叙述中错误的是( )
甲、乙两种固体物质的溶解度曲线如图所示.下列有关叙述中错误的是( )| A. | 40℃时甲的溶解度比乙的大 | |
| B. | 将甲、乙的饱和溶液40℃降到30℃,析出的甲的质量大 | |
| C. | 升高温度可将甲的饱和溶液变为不饱和溶液 | |
| D. | 30℃时,甲和乙的饱和溶液各100g,其溶质的质量相等 |
8.下列物质的名称、俗名、化学式完全正确的一组是( )
| A. | 碳酸钠、纯碱、小苏打、Na2CO3 | B. | 碳酸钙、生石灰、石灰石、CaCO3 | ||
| C. | 氢氧化钠、烧碱、火碱、苛性钠、NaOH | D. | 氢氧化钙、熟石灰、碱石灰、Ca(OH)2 |
7.温度不变,向一瓶饱和KNO3溶液中再加入一块KNO3的晶体,则下列说法正确的是( )
| A. | 晶体的形状发生改变,质量不变 | B. | 溶液中溶质的质量分数增大 | ||
| C. | 晶体质量减少 | D. | KNO3溶质的溶解度改变 |
6.我国著名化学家侯徳榜先生作出的重大贡献是( )
| A. | 发明黑火药 | B. | 发现了新元素 | ||
| C. | 改进了纯碱的生产 | D. | 发明了湿法冶金术 |
5.镁及其化合物在生产、生活中应用广泛.
(1)从海水中提取金属镁,可按图1流程进行:
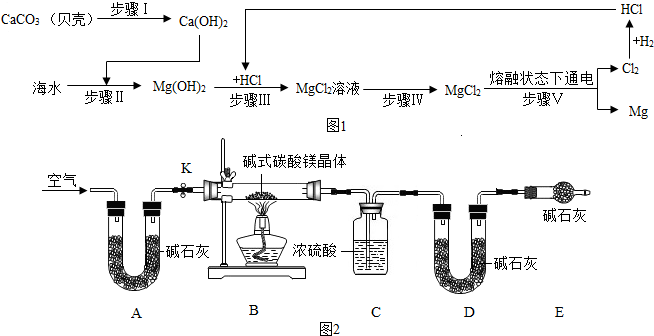
①下列说法正确的是B(填字母).
A.步骤Ⅰ通过一步反应即可实现 B.步骤Ⅱ、Ⅲ、Ⅳ的目的是从海水中提纯氯化镁
C.步骤Ⅴ中化学能转化为电能 D.该流程涉及的基本反应类型有4种
②该流程中采取的一种降低成本且减少污染的措施是电解产生的Cl2用于生产HCl,与Mg(OH)2发生中和反应.
(2)某化学兴趣小组对某种碱式碳酸镁晶体的组成进行探究.
【查阅资料】①碱式碳酸镁晶体可以表示为xMgCO3•yMg(OH)2•zH2O;②Mg(OH)2、MgCO3受热均能分解生成对应的氧化物;③碱石灰是固体氢氧化钠和生石灰等物质的混合物.
【设计实验】该小组同学设计了图2所示的实验装置,假设每步反应和吸收均进行完全.
【进行实验】取23.3g碱式碳酸镁晶体进行实验,步骤如下:
①连接好装置并检查气密性.
②装入药品,打开活塞K,通入一段时间空气.③分别称量装置C、D的质量(数据见右表).
④关闭活塞K,点燃酒精灯,使碱式碳酸镁晶体完全分解.
⑤停止加热,同时打开活塞K,通入空气至恢复到室温.
⑥再次分别称量装置C、D的质量(数据见表).
【实验分析】
①装置A的作用为除去空气中的二氧化碳和水,装置D的作用为吸收反应生成的二氧化碳.
②反应后,装置B中的剩余固体是MgO(或氧化镁),质量为10g.
③该碱式碳酸镁晶体[xMgCO3•yMg(OH)2•zH2O]中,x:y:z=4:1:4(写最简整数比).
0 163460 163468 163474 163478 163484 163486 163490 163496 163498 163504 163510 163514 163516 163520 163526 163528 163534 163538 163540 163544 163546 163550 163552 163554 163555 163556 163558 163559 163560 163562 163564 163568 163570 163574 163576 163580 163586 163588 163594 163598 163600 163604 163610 163616 163618 163624 163628 163630 163636 163640 163646 163654 211419
(1)从海水中提取金属镁,可按图1流程进行:

①下列说法正确的是B(填字母).
A.步骤Ⅰ通过一步反应即可实现 B.步骤Ⅱ、Ⅲ、Ⅳ的目的是从海水中提纯氯化镁
C.步骤Ⅴ中化学能转化为电能 D.该流程涉及的基本反应类型有4种
②该流程中采取的一种降低成本且减少污染的措施是电解产生的Cl2用于生产HCl,与Mg(OH)2发生中和反应.
(2)某化学兴趣小组对某种碱式碳酸镁晶体的组成进行探究.
【查阅资料】①碱式碳酸镁晶体可以表示为xMgCO3•yMg(OH)2•zH2O;②Mg(OH)2、MgCO3受热均能分解生成对应的氧化物;③碱石灰是固体氢氧化钠和生石灰等物质的混合物.
【设计实验】该小组同学设计了图2所示的实验装置,假设每步反应和吸收均进行完全.
| 装置C的质量 | 装置D的质量 | |
| 步骤③ | 292.4g | 198.2g |
| 步骤⑥ | 296.9g | 207.0g |
①连接好装置并检查气密性.
②装入药品,打开活塞K,通入一段时间空气.③分别称量装置C、D的质量(数据见右表).
④关闭活塞K,点燃酒精灯,使碱式碳酸镁晶体完全分解.
⑤停止加热,同时打开活塞K,通入空气至恢复到室温.
⑥再次分别称量装置C、D的质量(数据见表).
【实验分析】
①装置A的作用为除去空气中的二氧化碳和水,装置D的作用为吸收反应生成的二氧化碳.
②反应后,装置B中的剩余固体是MgO(或氧化镁),质量为10g.
③该碱式碳酸镁晶体[xMgCO3•yMg(OH)2•zH2O]中,x:y:z=4:1:4(写最简整数比).
 如图中甲、乙、丙、丁是初中化学中常见的物质,均由两种或三种元素组成,其中甲是胃液中帮助消化的成分,乙俗称消石灰.图中“-”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去.
如图中甲、乙、丙、丁是初中化学中常见的物质,均由两种或三种元素组成,其中甲是胃液中帮助消化的成分,乙俗称消石灰.图中“-”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去.