题目内容
10.欲使含有盐酸的氯化钙溶液变成中性,不用指示剂,应该加入下列试剂中的( )| A. | 纯碱 | B. | 生石灰 | C. | 石灰石 | D. | 熟石灰 |
分析 氯化钙溶液因含有盐酸显酸性要变为中性,即是要除去其中的盐酸.注意过程中不能增加其他可溶性的杂质,并要确实把盐酸反应掉,而不使用指示剂.
解答 解:A、纯碱的主要成分是碳酸钠能与盐酸反应生成氯化钠虽能除去盐酸但却增加了新的杂质.故不选;
B、生石灰的主要成分是氧化钙,能与水反应生成氢氧化钙,可以盐酸反应生成氯化钙,反应时无明显现象,不好控制加入的量.故不选;
C、石灰石的主要成分是碳酸钙能与盐酸反应生成氯化钙,且碳酸钙不溶于水,可加入过量的石灰石粉末以盐酸除去.故选;
D、熟石灰的主要成分是氢氧化钙,能与盐酸反应生成氯化钙,反应时无明显现象不好控制加入的量.故不选.
故选C.
点评 解答除杂相关问题时要把握如下原则:①选用的试剂要能将杂质除去但不能与要保留的物质反应②在除杂的同时不能增加新的杂质.一般的方法是将杂质转化为要保留的物质.

练习册系列答案
相关题目
20.化学与生产、生活、社会发展紧密相连.下列说法中,不正确的是( )
| A. | 香肠中加入大量的亚硝酸钠作防腐剂 | |
| B. | 冬天室内用煤炉取暖要严防煤气中毒 | |
| C. | 做面包时可用适量的小苏打作发酵粉 | |
| D. | 使用燃煤脱硫技术能有效防止酸雨的形成 |
18.下列各组离子在水中能大量共存的是( )
| A. | K+、NO3-、OH- | B. | H+、Na+、HCO3- | C. | H+、SO42-、OH- | D. | NH4+、NO3-、OH- |
5.镁及其化合物在生产、生活中应用广泛.
(1)从海水中提取金属镁,可按图1流程进行:
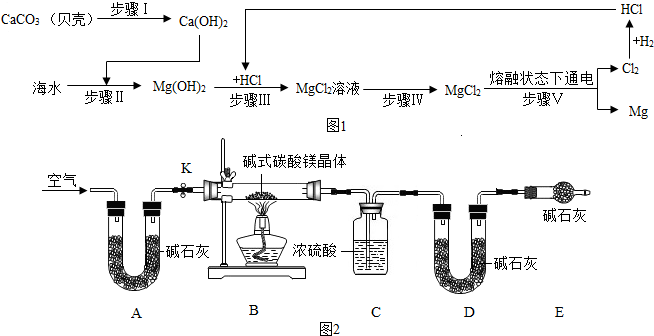
①下列说法正确的是B(填字母).
A.步骤Ⅰ通过一步反应即可实现 B.步骤Ⅱ、Ⅲ、Ⅳ的目的是从海水中提纯氯化镁
C.步骤Ⅴ中化学能转化为电能 D.该流程涉及的基本反应类型有4种
②该流程中采取的一种降低成本且减少污染的措施是电解产生的Cl2用于生产HCl,与Mg(OH)2发生中和反应.
(2)某化学兴趣小组对某种碱式碳酸镁晶体的组成进行探究.
【查阅资料】①碱式碳酸镁晶体可以表示为xMgCO3•yMg(OH)2•zH2O;②Mg(OH)2、MgCO3受热均能分解生成对应的氧化物;③碱石灰是固体氢氧化钠和生石灰等物质的混合物.
【设计实验】该小组同学设计了图2所示的实验装置,假设每步反应和吸收均进行完全.
【进行实验】取23.3g碱式碳酸镁晶体进行实验,步骤如下:
①连接好装置并检查气密性.
②装入药品,打开活塞K,通入一段时间空气.③分别称量装置C、D的质量(数据见右表).
④关闭活塞K,点燃酒精灯,使碱式碳酸镁晶体完全分解.
⑤停止加热,同时打开活塞K,通入空气至恢复到室温.
⑥再次分别称量装置C、D的质量(数据见表).
【实验分析】
①装置A的作用为除去空气中的二氧化碳和水,装置D的作用为吸收反应生成的二氧化碳.
②反应后,装置B中的剩余固体是MgO(或氧化镁),质量为10g.
③该碱式碳酸镁晶体[xMgCO3•yMg(OH)2•zH2O]中,x:y:z=4:1:4(写最简整数比).
(1)从海水中提取金属镁,可按图1流程进行:

①下列说法正确的是B(填字母).
A.步骤Ⅰ通过一步反应即可实现 B.步骤Ⅱ、Ⅲ、Ⅳ的目的是从海水中提纯氯化镁
C.步骤Ⅴ中化学能转化为电能 D.该流程涉及的基本反应类型有4种
②该流程中采取的一种降低成本且减少污染的措施是电解产生的Cl2用于生产HCl,与Mg(OH)2发生中和反应.
(2)某化学兴趣小组对某种碱式碳酸镁晶体的组成进行探究.
【查阅资料】①碱式碳酸镁晶体可以表示为xMgCO3•yMg(OH)2•zH2O;②Mg(OH)2、MgCO3受热均能分解生成对应的氧化物;③碱石灰是固体氢氧化钠和生石灰等物质的混合物.
【设计实验】该小组同学设计了图2所示的实验装置,假设每步反应和吸收均进行完全.
| 装置C的质量 | 装置D的质量 | |
| 步骤③ | 292.4g | 198.2g |
| 步骤⑥ | 296.9g | 207.0g |
①连接好装置并检查气密性.
②装入药品,打开活塞K,通入一段时间空气.③分别称量装置C、D的质量(数据见右表).
④关闭活塞K,点燃酒精灯,使碱式碳酸镁晶体完全分解.
⑤停止加热,同时打开活塞K,通入空气至恢复到室温.
⑥再次分别称量装置C、D的质量(数据见表).
【实验分析】
①装置A的作用为除去空气中的二氧化碳和水,装置D的作用为吸收反应生成的二氧化碳.
②反应后,装置B中的剩余固体是MgO(或氧化镁),质量为10g.
③该碱式碳酸镁晶体[xMgCO3•yMg(OH)2•zH2O]中,x:y:z=4:1:4(写最简整数比).
2.下列溶液长期放置在敞口容器中发生化学变化减少的是( )
| A. | 氢氧化钙溶液 | B. | 浓盐酸 | C. | 氢氧化钠溶液 | D. | 浓硫酸 |
