12. 在氢氧化钠和碳酸钠的混合溶液中不断滴加稀盐酸,测得产生气体的质量与加入的稀盐酸的质量关系如图所示,结合实验,分析图象后你认为说法不正确的是:
在氢氧化钠和碳酸钠的混合溶液中不断滴加稀盐酸,测得产生气体的质量与加入的稀盐酸的质量关系如图所示,结合实验,分析图象后你认为说法不正确的是:
 在氢氧化钠和碳酸钠的混合溶液中不断滴加稀盐酸,测得产生气体的质量与加入的稀盐酸的质量关系如图所示,结合实验,分析图象后你认为说法不正确的是:
在氢氧化钠和碳酸钠的混合溶液中不断滴加稀盐酸,测得产生气体的质量与加入的稀盐酸的质量关系如图所示,结合实验,分析图象后你认为说法不正确的是:| A. | 证明氢氧化钠变质实验中,滴加几滴稀盐酸没有气泡产生,说明氢氧化钠没有变质 | |
| B. | 图中OA段,表示氢氧化钠的量在减少 | |
| C. | 图中A点对应的溶液中滴加酚酞,酚酞变红色 | |
| D. | 图中B点对应的溶液中只有一种溶质 |
7.假如在宇宙中发现一个与地球相似的星球,经测定该星球大气中的气体成分如下:CO2占15%,N2占79%,O2占5%,其他气体占1%.为了有利于人类的生存,首先种植绿色植物,经过光合作用使它的成分与地球相似后,该星球的大气压强将( )
| A. | 增大 | B. | 减少 | C. | 不变 | D. | 无法判断 |
5. 石灰石样品的主要成分是碳酸钙(已知其他杂志不与盐酸反应).课外小组同学将50g盐酸分5次加入到20g该石灰石样品中,得到如下部分数据和图象:
石灰石样品的主要成分是碳酸钙(已知其他杂志不与盐酸反应).课外小组同学将50g盐酸分5次加入到20g该石灰石样品中,得到如下部分数据和图象:
请计算:所加盐酸的溶质质量分数.
0 163014 163022 163028 163032 163038 163040 163044 163050 163052 163058 163064 163068 163070 163074 163080 163082 163088 163092 163094 163098 163100 163104 163106 163108 163109 163110 163112 163113 163114 163116 163118 163122 163124 163128 163130 163134 163140 163142 163148 163152 163154 163158 163164 163170 163172 163178 163182 163184 163190 163194 163200 163208 211419
 石灰石样品的主要成分是碳酸钙(已知其他杂志不与盐酸反应).课外小组同学将50g盐酸分5次加入到20g该石灰石样品中,得到如下部分数据和图象:
石灰石样品的主要成分是碳酸钙(已知其他杂志不与盐酸反应).课外小组同学将50g盐酸分5次加入到20g该石灰石样品中,得到如下部分数据和图象:| 次数 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
| 加入盐酸的质量/g | 10 | 10 | 10 | 10 | 10 |
| 剩余固体的质量/g | 16 | 12 | 8 | 4 | 4 |
 向铜银混合物中,加入溶质质量分数为10%的硝酸银溶液340g,恰好完全反应,请结合图提供的数据计算.求:
向铜银混合物中,加入溶质质量分数为10%的硝酸银溶液340g,恰好完全反应,请结合图提供的数据计算.求:
 某同学进行如图所示的实验:
某同学进行如图所示的实验: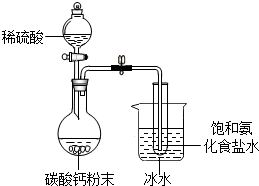 某化学兴趣小组在学习了候氏联合制碱法后,运用下图实验装置和其他实验设备成功制得了纯碱--碳酸钠.
某化学兴趣小组在学习了候氏联合制碱法后,运用下图实验装置和其他实验设备成功制得了纯碱--碳酸钠.