7.A、B、C、D四个试剂瓶中分别盛碳酸钠、硝酸银、烧碱、稀硫酸四种稀溶液中的一种,取四种溶液各少量,依次滴入物质X的溶液和稀硝酸,发生的现象如表所示:
(1)物质X的化学式是BaCl2.
(2)物质B是,加入X后反应的化学方程式是Na2CO3+BaCl2=2NaCl+BaCO3↓,加稀硝酸后,沉淀消失的反应化学方程式是BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑.
(3)为进一步区别A和C,可根据金属活动顺序表选择一种金属单质进行实验,写出其中一个反应的化
学方程式Fe+2AgNO3=Fe(NO3)2+2Ag(或Fe+H2SO4=FeSO4+H2↑).
| A | B | C | D | |
| X | 白色沉淀 | 白色沉淀 | 白色沉淀 | 无现象 |
| 稀硝酸 | 沉淀不消失 | 沉淀消失,有气体产生 | 沉淀不消失 | 无现象 |
(2)物质B是,加入X后反应的化学方程式是Na2CO3+BaCl2=2NaCl+BaCO3↓,加稀硝酸后,沉淀消失的反应化学方程式是BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑.
(3)为进一步区别A和C,可根据金属活动顺序表选择一种金属单质进行实验,写出其中一个反应的化
学方程式Fe+2AgNO3=Fe(NO3)2+2Ag(或Fe+H2SO4=FeSO4+H2↑).
6.为了鉴别碳酸钾溶液和氢氧化钾溶液,同学们进行了探究实验,分别取两种溶液于两支试管中,各滴入一定量的氯化钙溶液,观察到一支试管出现白色浑浊,实验结束后,同学们将废液倒入同一个干净的烧杯中,发现废液变浑浊,同学们对废液进行了过滤,并对滤液的成分进行了探究.
【提出问题】滤液中除水外还含有那些物质?
【查阅资料】碳酸钾溶液显碱性
【猜想】A.可能含有氢氧化钾、氯化钾和碳酸钾
B.可能含有氢氧化钾、氯化钾
C.可能含有氢氧化钾、氯化钾、碳酸钾和氯化钙
你认为还可能是氢氧化钾、氯化钾和氯化钙(写出一种猜想)
【讨论】你认为C猜想不合理(填字母),请说明理由氯化钙和碳酸钾反应生成氯化钾和碳酸钙沉淀.
【实验设计】设计一个简单的实验,证明你的猜想正确.
【反思交流】写出碳酸钾与氯化钙反应的化学方程式K2CO3+CaCl2═CaCO3↓+2KCl,在分析化学反应后所得物质的成分时,除考虑生成物外还需考虑反应物是否剩余.
【提出问题】滤液中除水外还含有那些物质?
【查阅资料】碳酸钾溶液显碱性
【猜想】A.可能含有氢氧化钾、氯化钾和碳酸钾
B.可能含有氢氧化钾、氯化钾
C.可能含有氢氧化钾、氯化钾、碳酸钾和氯化钙
你认为还可能是氢氧化钾、氯化钾和氯化钙(写出一种猜想)
【讨论】你认为C猜想不合理(填字母),请说明理由氯化钙和碳酸钾反应生成氯化钾和碳酸钙沉淀.
【实验设计】设计一个简单的实验,证明你的猜想正确.
| 实验步骤 | 实验现象 | 实验结论 |
| 取样于试管中,滴加适量的碳酸钾溶液. | 出现白色沉淀. | 猜想正确 |
1.某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动.以下是教学片段,请你参与学习并帮助填写空格(包括表中空格).
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
【学生板演】该反应的化学方程式H2SO4+2NaOH═Na2SO4 +2H2O.
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么?
【假设猜想】针对疑问,大家纷纷提出猜想.甲组同学的猜想如下,请你补上猜想四.
猜想一:只有Na2SO4
猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4、H2SO4和NaOH
猜想四:Na2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是三,理由是氢氧化钠与硫酸会反应,不会同时剩余.
【实验探究】
(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有NaOH或氢氧化钠.
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用了老师提供的pH试纸、Na2CO3溶液、BaC12溶液,进行如下三个方案的探究.
【得出结论】通过探究,全班同学一致确定猜想二是正确的.
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予了肯定.同时指出(2)中存在两处明显错误,请大家反思.同学们经过反思发现了如下两处错误:
①实验操作中的错误是pH试纸浸入溶液中;
②实验方案中也有一个是错误的,错误的原因是BaCl2与Na2SO4反应也会生成白色沉淀,不能证明一定有H2SO4存在.
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
【学生板演】该反应的化学方程式H2SO4+2NaOH═Na2SO4 +2H2O.
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么?
【假设猜想】针对疑问,大家纷纷提出猜想.甲组同学的猜想如下,请你补上猜想四.
猜想一:只有Na2SO4
猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4、H2SO4和NaOH
猜想四:Na2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是三,理由是氢氧化钠与硫酸会反应,不会同时剩余.
【实验探究】
(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有NaOH或氢氧化钠.
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用了老师提供的pH试纸、Na2CO3溶液、BaC12溶液,进行如下三个方案的探究.
| 实验方案 | 测溶液的pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 实验操作 | 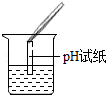 | 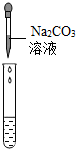 | 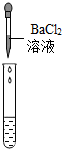 |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 产生白色沉淀 | |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予了肯定.同时指出(2)中存在两处明显错误,请大家反思.同学们经过反思发现了如下两处错误:
①实验操作中的错误是pH试纸浸入溶液中;
②实验方案中也有一个是错误的,错误的原因是BaCl2与Na2SO4反应也会生成白色沉淀,不能证明一定有H2SO4存在.
20.小明家有包开启了的小苏打,久置在灶台上方,可能因受热而变质.小明为此 开展了探究,请分析其过程完成填空.
【查阅资料】
①2NaHCO$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O
②NaHCO3+NaOH═Na2CO3+H2O
③2NaHCO3+Ca(OH)2═CaCO3↓+Na2CO3+2H2O
④Ca(HCO3)2+Na2CO3═CaCO3↓+2NaHCO3
⑤Na2CO3受热不分解,NaHCO3、Ca(HCO3)2都能溶与水.
【假设猜想】
假设一:小苏打没有变质,化学成分为 NaHCO3;
假设二:小苏打完全变质,化学成分为Na2CO3;
假设三:小苏打部分变质,化学成分为NaHCO3和Na2CO3.
【实验方案】
可选药品:①Ca(OH)2溶液 ②CaCl2溶液 ③NaOH溶液 ④稀盐酸
【问题讨论】
有同学认为,取一定量样品直接加热,再将产生的气体通入澄清石灰水,根据实验现象,对上述三种假设的每一种是否成立都能进行判断.请评价这种方案是否合理并说明理由否;不能判断是部分还是没有变质的情况.
0 151002 151010 151016 151020 151026 151028 151032 151038 151040 151046 151052 151056 151058 151062 151068 151070 151076 151080 151082 151086 151088 151092 151094 151096 151097 151098 151100 151101 151102 151104 151106 151110 151112 151116 151118 151122 151128 151130 151136 151140 151142 151146 151152 151158 151160 151166 151170 151172 151178 151182 151188 151196 211419
【查阅资料】
①2NaHCO$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O
②NaHCO3+NaOH═Na2CO3+H2O
③2NaHCO3+Ca(OH)2═CaCO3↓+Na2CO3+2H2O
④Ca(HCO3)2+Na2CO3═CaCO3↓+2NaHCO3
⑤Na2CO3受热不分解,NaHCO3、Ca(HCO3)2都能溶与水.
【假设猜想】
假设一:小苏打没有变质,化学成分为 NaHCO3;
假设二:小苏打完全变质,化学成分为Na2CO3;
假设三:小苏打部分变质,化学成分为NaHCO3和Na2CO3.
【实验方案】
可选药品:①Ca(OH)2溶液 ②CaCl2溶液 ③NaOH溶液 ④稀盐酸
| 实验操作 | 实验现象 | 实验结论 |
| 操作一:取小苏打样品少量溶于足 量水后,加入过量的②(填药品编 号,下同),观察,如有沉淀,则继续进行下一步操作. 操作二:待操作一中反应充分后过 滤,并在滤液中加入过量的④,观察. | 操作一中无沉淀出现 | 假设一成立 |
| 操作一中有沉淀出现 | 假设二成立 | |
| 操作二中产生气泡 | 假设三成立 |
有同学认为,取一定量样品直接加热,再将产生的气体通入澄清石灰水,根据实验现象,对上述三种假设的每一种是否成立都能进行判断.请评价这种方案是否合理并说明理由否;不能判断是部分还是没有变质的情况.


 如图所示,广口瓶中盛有少量饱和澄清石灰水,小试管和U形管中均有适量水,现向小试管中注入适量浓硫酸.请回答:
如图所示,广口瓶中盛有少量饱和澄清石灰水,小试管和U形管中均有适量水,现向小试管中注入适量浓硫酸.请回答: 请认真回忆物质与其构成粒子之间的关系,回答下列问题:
请认真回忆物质与其构成粒子之间的关系,回答下列问题: