11.已知M元素原子最外层电子数为3,N元素原子最外层电子数为6,M、N两种元素形成化合物的化学式为( )
| A. | N3M2 | B. | M3N6 | C. | M3N2 | D. | M2N3 |
10.下列说法中正确的是( )
| A. | 橡胶、纤维、塑料都是合成有机高分子材料 | |
| B. | 用水可以灭火,因为水可以降低可燃物的着火点 | |
| C. | 为增加肥效,把硝酸铵和草木灰混合使用 | |
| D. | 气味能闻得到却看不到,说明分子很小 |
9.化学推动了杜会的进步,使我们的生活绚丽多彩.下列过程本质上与其他不同的是( )
| A. | 工业上利用空气制氧气 | B. | 用海水晒盐 | ||
| C. | 利用白炽灯照明 | D. | 火力发电 |
4.电石,学名碳化钙(CaC2),以焦炭和碳酸钙为原料生产碳化钙并制备重要工业原料乙炔(CxHy)气体的原理如图.

【实验探究】
(1)气体C有毒,写出固体A和焦炭反应得到碳化钙的化学方程式为CaO+3C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO↑.
(2)小组同学对固体D提出三种猜想:
猜想一:氧化钙;
猜想二:氢氧化钙;
猜想三:碳酸钙.
同学们经过分析将猜想一排除了,理由是氧化钙与水反应生成氢氧化钙.
(3)检验固体D:取样,滴加足量的稀盐酸,观察到固体溶解,无气泡产生,猜想二正确.
【组成测定】
(一)实验设计:
将一定量的乙炔(CxHy)在足量的氧气中完全燃烧,生成的气体全部缓缓通过下图Ⅱ装置(选填“Ⅰ”或“Ⅱ”).

(二)实验测定:(小资料:乙炔的相对分子质量为26)
实验数据记录于下表中,试通过计算,确定乙炔的化学式.
结论:乙炔的化学式C2H2.
【归纳小结】写出碳化钙与水反应的化学方程式:CaC2+2H2O=Ca(OH)2+C2H2↑.

【实验探究】
(1)气体C有毒,写出固体A和焦炭反应得到碳化钙的化学方程式为CaO+3C$\frac{\underline{\;高温\;}}{\;}$CaC2+CO↑.
(2)小组同学对固体D提出三种猜想:
猜想一:氧化钙;
猜想二:氢氧化钙;
猜想三:碳酸钙.
同学们经过分析将猜想一排除了,理由是氧化钙与水反应生成氢氧化钙.
(3)检验固体D:取样,滴加足量的稀盐酸,观察到固体溶解,无气泡产生,猜想二正确.
【组成测定】
(一)实验设计:
将一定量的乙炔(CxHy)在足量的氧气中完全燃烧,生成的气体全部缓缓通过下图Ⅱ装置(选填“Ⅰ”或“Ⅱ”).

(二)实验测定:(小资料:乙炔的相对分子质量为26)
实验数据记录于下表中,试通过计算,确定乙炔的化学式.
| 反应前质量/g | 反应后质量/g | |
| 装置① | 125.3 | 127.1 |
| 装置② | 78.2 | 87.0 |
【归纳小结】写出碳化钙与水反应的化学方程式:CaC2+2H2O=Ca(OH)2+C2H2↑.
3.在一次化学实验中,同学们将饱和硫酸铜溶液逐滴加到5mL饱和氢氧化钠溶液中,观察到以下异常实验现象:
已知蓝色沉淀是氢氧化铜,写出生成蓝色沉淀的化学方程式CuSO4+2NaOH=Na2SO4+Cu(OH)2↓.
【提出问题】实验①中蓝色沉淀为什么消失?
【查阅资料】
Ⅰ.氢氧化铜在室温下温度,70℃~80℃时分解生成氧化铜.
Ⅱ.铜酸钠[Na2Cu(OH)4]溶于水,溶液呈亮蓝色.
【猜想与假设】
Ⅰ.蓝色沉淀消失可能是氢氧化铜发生分解反应.
Ⅱ.蓝色沉淀消失可能是氢氧化铜溶解在氢氧化钠溶液中,形成亮蓝色溶液.
甲同学认为猜想Ⅰ不成立,理由是氢氧化铜分解生成黑色的氧化铜固体.
乙同学为验证猜想Ⅱ,进行了如下实验.
【进行实验】
【解释与结论】
(1)1号试管中现象为蓝色固体不消失.
(2)上述实验得出的结论是氢氧化铜能溶解在高于20%的NaOH中形成亮蓝色溶液.
【反思与评价】
(1)进一步查阅资料可知,氢氧化铜在氢氧化钠溶液中溶解生成铜酸钠,反应的化学方程式为2NaOH+Cu(OH)2=Na2Cu(OH)4.
(2)丙同学推知饱和硫酸铜溶液与饱和氢氧化钠溶液的反应是放热反应,他依据的实验现象是蓝色沉淀逐渐变为黑色.
0 147378 147386 147392 147396 147402 147404 147408 147414 147416 147422 147428 147432 147434 147438 147444 147446 147452 147456 147458 147462 147464 147468 147470 147472 147473 147474 147476 147477 147478 147480 147482 147486 147488 147492 147494 147498 147504 147506 147512 147516 147518 147522 147528 147534 147536 147542 147546 147548 147554 147558 147564 147572 211419
| 实验序号 | 滴加CuSO4溶液的量 | 实验现象 |
| ① | 第1~6滴 | 产生蓝色沉淀,但振荡后沉淀消失,形成亮蓝色溶液 |
| ② | 第7~9滴 | 产生蓝色沉淀,且沉淀逐渐增多.振荡后沉淀不消失,很快沉淀逐渐变成黑色 |
【提出问题】实验①中蓝色沉淀为什么消失?
【查阅资料】
Ⅰ.氢氧化铜在室温下温度,70℃~80℃时分解生成氧化铜.
Ⅱ.铜酸钠[Na2Cu(OH)4]溶于水,溶液呈亮蓝色.
【猜想与假设】
Ⅰ.蓝色沉淀消失可能是氢氧化铜发生分解反应.
Ⅱ.蓝色沉淀消失可能是氢氧化铜溶解在氢氧化钠溶液中,形成亮蓝色溶液.
甲同学认为猜想Ⅰ不成立,理由是氢氧化铜分解生成黑色的氧化铜固体.
乙同学为验证猜想Ⅱ,进行了如下实验.
【进行实验】
| 实验操作 | 实验现象 |
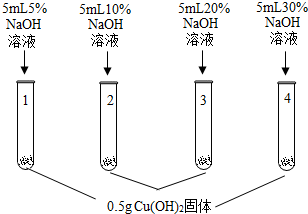 | 1号试管,… 2号试管,蓝色固体不消失 3号试管,蓝色固体减少 4号试管,蓝色固体消失,得到亮蓝色溶液 |
(1)1号试管中现象为蓝色固体不消失.
(2)上述实验得出的结论是氢氧化铜能溶解在高于20%的NaOH中形成亮蓝色溶液.
【反思与评价】
(1)进一步查阅资料可知,氢氧化铜在氢氧化钠溶液中溶解生成铜酸钠,反应的化学方程式为2NaOH+Cu(OH)2=Na2Cu(OH)4.
(2)丙同学推知饱和硫酸铜溶液与饱和氢氧化钠溶液的反应是放热反应,他依据的实验现象是蓝色沉淀逐渐变为黑色.

