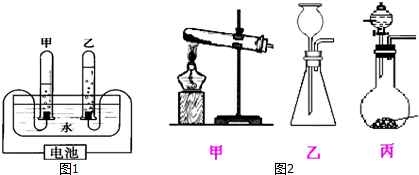
20.大豆是大众喜爱的食材之一,由大豆制作豆腐是中国古代一项重要发明,现成为全球颇 受欢迎的食品,豆腐中含有人们生活所需的各类营养素,每 100 克豆腐中含各种营养成分如表:
①表中 X 代表六类营养素中的糖类
②豆腐中含有人体所需的微量元素是Fe
③豆腐制作的工艺流程中有一过程“点豆腐”,即在豆浆中加入某种盐,使溶解在水中蛋白质 溶解度变小而析出,据你分析,加入的盐可能是C.(填序号)
A.BaCl2B. CuSO4C. CaSO44D.AgNO3
④豆腐的制作时有一“煮浆”的过程,“煮浆”时用煤作燃料,通常将煤块加工成蜂窝煤,其 原因是增大接触面积,使充分燃烧,“煮浆”结束后,若不继续加煤,火焰会逐渐熄灭,原因是缺少可燃物
⑤大豆在生长过程需要施用复合肥,则你建议施用的化肥是C.(填序号)
A.KClB.(NH4)2SO4C.KH2PO4D.NH4NO3
⑥用大豆榨油时,油坊师傅身上衣服上油渍用清水很难洗去,但加入洗涤剂就很容易洗净,原因是洗涤剂具有乳化作用.
| 成分 | 水 | 蛋白质 | 油脂 | X | 钙 | 铁 | 磷 | 维生素 B1 | 维生素 B2 |
| 质量(g) | 89.3 | 4.7 | 1.3 | 2.8 | 0.24 | 1.4 | 0.064 | 0.00006 | 0.00003 |
②豆腐中含有人体所需的微量元素是Fe
③豆腐制作的工艺流程中有一过程“点豆腐”,即在豆浆中加入某种盐,使溶解在水中蛋白质 溶解度变小而析出,据你分析,加入的盐可能是C.(填序号)
A.BaCl2B. CuSO4C. CaSO44D.AgNO3
④豆腐的制作时有一“煮浆”的过程,“煮浆”时用煤作燃料,通常将煤块加工成蜂窝煤,其 原因是增大接触面积,使充分燃烧,“煮浆”结束后,若不继续加煤,火焰会逐渐熄灭,原因是缺少可燃物
⑤大豆在生长过程需要施用复合肥,则你建议施用的化肥是C.(填序号)
A.KClB.(NH4)2SO4C.KH2PO4D.NH4NO3
⑥用大豆榨油时,油坊师傅身上衣服上油渍用清水很难洗去,但加入洗涤剂就很容易洗净,原因是洗涤剂具有乳化作用.
19. 实验小组探究盐酸和氢氧化钠反应过程中溶液 pH 的变化规律,得到如图所示曲线.下列 有关该实验事实的说法正确的是( )
实验小组探究盐酸和氢氧化钠反应过程中溶液 pH 的变化规律,得到如图所示曲线.下列 有关该实验事实的说法正确的是( )
 实验小组探究盐酸和氢氧化钠反应过程中溶液 pH 的变化规律,得到如图所示曲线.下列 有关该实验事实的说法正确的是( )
实验小组探究盐酸和氢氧化钠反应过程中溶液 pH 的变化规律,得到如图所示曲线.下列 有关该实验事实的说法正确的是( )| A. | 该实验是将氢氧化钠溶液滴入盐酸中 | |
| B. | B 点表示盐酸和氢氧化钠恰好完全反应 | |
| C. | C 点时的溶液能使酚酞试液变红 | |
| D. | A 点时,溶液中的溶质有氯化钠和氢氧化钠 |
18.在一密闭容器中,有甲、乙、丙、丁四种物质,一定条件下充分反应,测得反应前后各物质的质量如表:下列说法正确的是( )
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前的质量/g | 54 | 17 | 20 | 10 |
| 反应后的质量/g | 10 | 0 | 2 | x |
| A. | x为89 | B. | 参加反应的丙物质的质量为20 g | ||
| C. | 该反应为分解反应 | D. | 甲物质全部反应完 |
16.向一定质量溶质质量分数为20%的硝酸钾溶液中同时加入4g硝酸钾和16g水所得的溶液中溶质质量分数为( )
| A. | 20% | B. | 15% | C. | 10% | D. | 无法计算 |
15.下列各组中的物质充分混合后,所得溶液的质量比反应前溶液的总质量减少的是( )
| A. | 锌和稀盐酸 | B. | 氢氧化铜和稀硫酸 | ||
| C. | 氢氧化钠溶液和硫酸铜溶液 | D. | 氯化钠溶液和稀盐酸 |
14.对化学概念的准确理解是正确运用的前提,下列有关认识不正确的是( )
0 147358 147366 147372 147376 147382 147384 147388 147394 147396 147402 147408 147412 147414 147418 147424 147426 147432 147436 147438 147442 147444 147448 147450 147452 147453 147454 147456 147457 147458 147460 147462 147466 147468 147472 147474 147478 147484 147486 147492 147496 147498 147502 147508 147514 147516 147522 147526 147528 147534 147538 147544 147552 211419
| A. | 氧化反应一定是化合反应 | |
| B. | 复分解反应中各元素的化合价一定不变 | |
| C. | 置换反应一定有单质生成 | |
| D. | 有盐和水生成的反应不一定是中和反应 |