题目内容
 6.5 g锌分别与10%和20%的稀硫酸反应,反应中稀硫酸溶液的质量和生成氢气的质量关系如图所示.
6.5 g锌分别与10%和20%的稀硫酸反应,反应中稀硫酸溶液的质量和生成氢气的质量关系如图所示.
| 实验I | 实验II | |
| 锌的质量 | 6.5g | 6.5g |
| 稀硫酸的质量分数 | 10% | 20% |
(2)实验Ⅰ中参加反应的10%的稀硫酸的体积是________mL.(10%的稀硫酸的密度是1.07 g/cm3,精确到0.1)
(3)6.5 g锌与足量的稀硫酸反应可以生成多少克氢气?
解:(1)因20%稀硫酸比10%稀硫酸的溶质质量分数大,因此20%稀硫酸与锌反应的速率大,所以图象中a点表示20%稀硫酸与锌恰好完全反应时生成氢气的质量.
设参加反应的10%稀硫酸的质量为x,生成氢气的质量为y.
Zn+H2SO4=ZnSO4+H2↑
65 98 2
6.5g x×10% y
(2) =
= ,x=98g
,x=98g
参加反应的10%稀硫酸的体积为 ≈91.6cm3
≈91.6cm3
(3)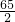 =
= ,y=0.2g
,y=0.2g
答:(1)20%稀硫酸与锌恰好完全反应时生成氢气的质量;
(2)91.6;
(3)生成氢气的质量为0.2g.
分析:(1)溶质质量分数大的稀硫酸与锌反应的速率大;
(2)由图象看出锌完全反应,因此可根据锌与硫酸反应的化学方程式,由锌的质量计算出参加反应的10%稀硫酸的体积;
(3)根据锌与硫酸反应的化学方程式,还可以由锌的质量计算出锌与足量稀硫酸反应生成氢气的质量.
点评:本题考查有关化学方程式的计算,由于涉及图表,难度较大.
设参加反应的10%稀硫酸的质量为x,生成氢气的质量为y.
Zn+H2SO4=ZnSO4+H2↑
65 98 2
6.5g x×10% y
(2)
 =
= ,x=98g
,x=98g参加反应的10%稀硫酸的体积为
 ≈91.6cm3
≈91.6cm3(3)
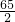 =
= ,y=0.2g
,y=0.2g答:(1)20%稀硫酸与锌恰好完全反应时生成氢气的质量;
(2)91.6;
(3)生成氢气的质量为0.2g.
分析:(1)溶质质量分数大的稀硫酸与锌反应的速率大;
(2)由图象看出锌完全反应,因此可根据锌与硫酸反应的化学方程式,由锌的质量计算出参加反应的10%稀硫酸的体积;
(3)根据锌与硫酸反应的化学方程式,还可以由锌的质量计算出锌与足量稀硫酸反应生成氢气的质量.
点评:本题考查有关化学方程式的计算,由于涉及图表,难度较大.

练习册系列答案
相关题目
(5分) 金属在日常生活中随处可见,研究金属的性质可以更好地利用金属。
(1)某兴趣小组的同学学习了金属的性质后,在实验室找到的一种银白色金属R做如下探究:
①将金属R投入稀盐酸中,金属表面有气泡冒出。则该金属R在金属活动性顺序表中排在氢的 (选填“前面”或“后面”)。
②将金属R投入到FeSO4溶液中,金属R表面有黑色物质析出。根据上述信息,判断金属Fe、R、Cu活动性由强到弱的顺序是 。
(2)工业生产中常用10%的稀盐酸来除铁制品表面的铁锈,写出盐酸除铁锈反应的化学方程式 ;
(3)将一定量铁粉加入到硫酸锌、硫酸铜的混合液中,充分反应后过滤。滤液中的溶质一定有 。
(4)取一定量镁、锌、铁三种金属,分别加入溶质质量分数相等的稀盐酸,充分反应后,生成氢气的质量相等。下列做法与此结果相符的是 (填序号)。
| A.相同质量的三种金属与足量的稀盐酸反应 |
| B.2.4 g镁、6.5 g锌、5.6 g铁与足量的稀盐酸反应 |
| C.向足量的镁、锌、铁中加入稀盐酸的质量比为2︰3︰2 |
| D.足量的三种金属与等量的稀盐酸反应 |
 6.5 g锌分别与10%和20%的稀硫酸反应,反应中稀硫酸溶液的质量和生成氢气的质量关系如图所示.
6.5 g锌分别与10%和20%的稀硫酸反应,反应中稀硫酸溶液的质量和生成氢气的质量关系如图所示.