题目内容
16. 如图是某硫酸试剂瓶标签上的部分文字说明.
如图是某硫酸试剂瓶标签上的部分文字说明.(1)取10 mL该硫酸可配制成9.8%的硫酸184g.
(2)取适量该硫酸与锌反应可生成S02气体:Zn+2H2SO4 (浓)═ZnSO4+SO2↑+2H2O.反应一段时间后,还可能生成另一种气体,请解释其原因随着反应进行,浓硫酸变为稀硫酸,锌与硫酸反应生成氢气.
分析 (1)利用稀释前后溶质的质量不变解决.
(2)随着硫酸的消耗和水的生成,硫酸变稀,锌与稀硫酸反应能生成氢气.
解答 解:(1)依据稀释前后溶质的质量不变,可设该硫酸的体积是x
x×1.84g/ml×98%=184×9.8%
则:x=10mL
(2)由浓硫酸与锌反应的方程式Zn+2H2SO4 (浓)=ZnSO4+SO2↑+2H2O可以看出随着硫酸的消耗和水的生成,硫酸变稀,这时就会发生锌与稀硫酸反应能生成氢气.
故答案为:(1)184;(2)随着硫酸的消耗和水的生成,硫酸变稀,锌与稀硫酸反应能生成氢气.
点评 此题是对硫酸相关知识的考查,解题的关键是对溶液的稀释以及浓硫酸与锌粒反应的分析,属常规性基础知识考查题.

练习册系列答案
相关题目
11.下列所示实验操作中,正确的是( )
| A. |  | B. |  | C. |  | D. |  |
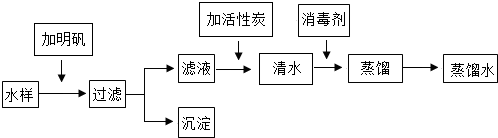
1.除去下列各物质中混有的少量杂质,所用除杂试剂及操作方法均正确的是( )
| 选项 | 物质 | 杂质 | 除杂试剂及操作方法 |
| A | 二氧化碳 | 一氧化碳 | 通入氧气,点燃 |
| B | 氯化钾溶液 | 碳酸钾 | 加入过量氯化钙溶液,充分反应后过滤 |
| C | 锌粉 | 铁粉 | 加入适量氯化锌溶液,充分反应后过滤 |
| D | 氢气 | 氯化氢 | 先通过过量氢氧化钠溶液,再通过过量浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
5. 如图为一组物质发生化学反应的示意图,其中□○◎●分别表示M、N、R、S四种不同元素的原子.由图分析下列结论正确的是( )
如图为一组物质发生化学反应的示意图,其中□○◎●分别表示M、N、R、S四种不同元素的原子.由图分析下列结论正确的是( )
 如图为一组物质发生化学反应的示意图,其中□○◎●分别表示M、N、R、S四种不同元素的原子.由图分析下列结论正确的是( )
如图为一组物质发生化学反应的示意图,其中□○◎●分别表示M、N、R、S四种不同元素的原子.由图分析下列结论正确的是( )| A. | 该反应属于分解反应 | B. | 反应物都是单质 | ||
| C. | 生成物的个数比是1:1 | D. | R在该反应中一定是催化剂 |
20.小林对下列符合中数字含义的理解正确的是( )
| A. | S2+:一个硫离子带2个单位正电荷 | |
| B. | Mn2+:锰元素的化合价为+2价 | |
| C. | NH3:该物质中N、H元素的个数比为1:3 | |
| D. | O2:2个氧原子 |