题目内容
某化学兴趣小组学习酸、碱、盐性质后,通过实验对盐酸、氢氧化钙的化学性质进行了验证和总结,如图所示“-”表示物质两两之间能发生化学反应.请根据如图,回答问题.
总结一:盐酸的化学性质
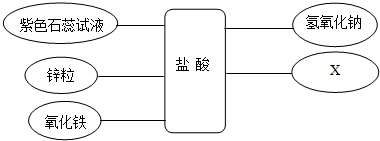
①写出氧化铁与盐酸的化学方程式 .
②补充一个实验,完善盐酸的化学性质,X可以是 (用化学式表示).
③能发生中和反应的化学方程式 .
④为测定某盐酸中溶质的质量分数,甲同学取该盐酸样品50g,向其中加入过量锌粒,充分反应后收集到0.15mol氢气,请完成下列计算与分析:
Ⅰ.计算:该盐酸中溶质的质量分数. (根据化学方程式计算,写出计算过程)
Ⅱ.分析:甲同学将测定结果与盐酸试剂瓶标签上所标的相关信息(浓盐酸溶质的质量分数为35%)进行对比,发现标签上溶质的质量分数与实际测得的值不符(实验过程无误),你认为原因可能是 .
总结二:氢氧化钙的化学性质
(已知:CaCl2溶液呈中性,CaCl2+Na2CO3→CaCO3↓+2NaCl)
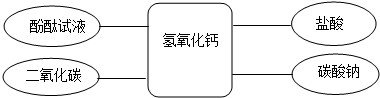
⑤乙同学将酚酞试液滴入氢氧化钙溶液中,观察到溶液变红,得出结论:氢氧化钙溶液呈 (填“酸性”、“碱性”或“中性”).
⑥丙同学将过量的稀盐酸加入到乙同学所得溶液中,观察到红色褪去,发生反应的化学方程式为 ,此时所得溶液中含有的溶质有 (酸碱指示剂除外).
⑦丁同学将碳酸钠溶液加入氢氧化钙溶液中,充分反应后,与丙同学所得溶液混合,静置后发现:上层为无色透明的溶液,底部有白色沉淀.则上层溶液中一定含有的溶质是
(酸碱指示剂除外),可能含有的溶质是 ;为验证可能含有的溶质,请写出实验操作过程与现象 .
总结一:盐酸的化学性质

①写出氧化铁与盐酸的化学方程式
②补充一个实验,完善盐酸的化学性质,X可以是
③能发生中和反应的化学方程式
④为测定某盐酸中溶质的质量分数,甲同学取该盐酸样品50g,向其中加入过量锌粒,充分反应后收集到0.15mol氢气,请完成下列计算与分析:
Ⅰ.计算:该盐酸中溶质的质量分数.
Ⅱ.分析:甲同学将测定结果与盐酸试剂瓶标签上所标的相关信息(浓盐酸溶质的质量分数为35%)进行对比,发现标签上溶质的质量分数与实际测得的值不符(实验过程无误),你认为原因可能是
总结二:氢氧化钙的化学性质
(已知:CaCl2溶液呈中性,CaCl2+Na2CO3→CaCO3↓+2NaCl)

⑤乙同学将酚酞试液滴入氢氧化钙溶液中,观察到溶液变红,得出结论:氢氧化钙溶液呈
⑥丙同学将过量的稀盐酸加入到乙同学所得溶液中,观察到红色褪去,发生反应的化学方程式为
⑦丁同学将碳酸钠溶液加入氢氧化钙溶液中,充分反应后,与丙同学所得溶液混合,静置后发现:上层为无色透明的溶液,底部有白色沉淀.则上层溶液中一定含有的溶质是
考点:酸的化学性质,有关溶质质量分数的简单计算,碱的化学性质,书写化学方程式、文字表达式、电离方程式,根据化学反应方程式的计算
专题:常见的酸 酸的通性,常见的碱 碱的通性
分析:(1)根据氧化铁与盐酸的化学反应正确书写化学方程式;
(2)根据酸的化学性解答;
(3)根据要求正确书写化学方程式;
(4)Ⅰ.根据氢气的质量来计算盐酸的溶质质量;
Ⅱ.根据浓盐酸的挥发性解答;
(5)根据能使酚酞变红色的溶液显碱性解答;
(6)根据氢氧化钙与盐酸反应的化学方程式,以及反应物是否有剩余等解答;
(7)根据实验现象来确定溶液成分.
(2)根据酸的化学性解答;
(3)根据要求正确书写化学方程式;
(4)Ⅰ.根据氢气的质量来计算盐酸的溶质质量;
Ⅱ.根据浓盐酸的挥发性解答;
(5)根据能使酚酞变红色的溶液显碱性解答;
(6)根据氢氧化钙与盐酸反应的化学方程式,以及反应物是否有剩余等解答;
(7)根据实验现象来确定溶液成分.
解答:解:(1)氧化铁与盐酸反应生成氯化铁和水,化学方程式为:Fe2O3+6HCl=2FeCl3+3H2O;
(2)根据酸的化学性质X为能与盐酸反应的盐;
(3)图中能发生中和反应的是氢氧化钠与稀盐酸,反应的化学方程式:NaOH+HCl=NaCl++H2O;
(4)Ⅰ解:设该盐酸中溶质的物质的量为x mol.
Zn+2HCl=ZnCl2+H2↑
2 1
x 0.15mol
=
x=0.3mol
盐酸中溶质的质量为0.3mol×36.5g/mol=10.95g
该盐酸中溶质的质量分数
×100%=21.9%
Ⅱ、因为浓盐酸具有挥发性,溶质扩散导致溶质质量变小;
(5)能使酚酞变红色的溶液显碱性;
(6)氢氧化钙与盐酸反应生成了氯化钙和水;应为所加盐酸过量,故所得溶液中含有的溶质有氯化钙和氯化氢;
(7)丁同学将碳酸钠溶液加入氢氧化钙溶液中,充分反应后,生成了氯化钠和碳酸钙沉淀,与丙同学所得溶液混合,静置后发现:上层为无色透明的溶液,底部有白色沉淀.说明盐酸已全部耗尽;氯化钙不能确定,故溶液中可能有氯化钙,一定有氯化钠;为验证可能氯化钙是否有可以取上层清液,滴入碳酸钠溶液,产生白色沉淀说明有CaCl2,否则没有.
答案:(1)Fe2O3+6HCl=2FeCl3+3H2O
(2)Na2CO3(能与盐酸反应的盐)
(3)NaOH+HCl=NaCl++H2O
(4)Ⅰ、21.9%
Ⅱ、浓盐酸具有挥发性,溶质扩散导致溶质质量变小
(5)碱性; (6)Ca(OH)2+2HCl=CaCl2+2H2O,CaCl2HCl
(7)NaCl,CaCl2,取上层清液,滴入碳酸钠溶液,产生白色沉淀说明有CaCl2.
(2)根据酸的化学性质X为能与盐酸反应的盐;
(3)图中能发生中和反应的是氢氧化钠与稀盐酸,反应的化学方程式:NaOH+HCl=NaCl++H2O;
(4)Ⅰ解:设该盐酸中溶质的物质的量为x mol.
Zn+2HCl=ZnCl2+H2↑
2 1
x 0.15mol
| 2 |
| x |
| 1 |
| 0.15mol |
x=0.3mol
盐酸中溶质的质量为0.3mol×36.5g/mol=10.95g
该盐酸中溶质的质量分数
| 10.95g |
| 50g |
Ⅱ、因为浓盐酸具有挥发性,溶质扩散导致溶质质量变小;
(5)能使酚酞变红色的溶液显碱性;
(6)氢氧化钙与盐酸反应生成了氯化钙和水;应为所加盐酸过量,故所得溶液中含有的溶质有氯化钙和氯化氢;
(7)丁同学将碳酸钠溶液加入氢氧化钙溶液中,充分反应后,生成了氯化钠和碳酸钙沉淀,与丙同学所得溶液混合,静置后发现:上层为无色透明的溶液,底部有白色沉淀.说明盐酸已全部耗尽;氯化钙不能确定,故溶液中可能有氯化钙,一定有氯化钠;为验证可能氯化钙是否有可以取上层清液,滴入碳酸钠溶液,产生白色沉淀说明有CaCl2,否则没有.
答案:(1)Fe2O3+6HCl=2FeCl3+3H2O
(2)Na2CO3(能与盐酸反应的盐)
(3)NaOH+HCl=NaCl++H2O
(4)Ⅰ、21.9%
Ⅱ、浓盐酸具有挥发性,溶质扩散导致溶质质量变小
(5)碱性; (6)Ca(OH)2+2HCl=CaCl2+2H2O,CaCl2HCl
(7)NaCl,CaCl2,取上层清液,滴入碳酸钠溶液,产生白色沉淀说明有CaCl2.
点评:解答本题关键是要知道酸碱指示剂遇到酸和碱变色情况,熟悉方程式的书写注意事项.

练习册系列答案
相关题目
如图中“●”和“○”分别表示不同的原子,其中表示混合物的是( )
A、 |
B、 |
C、 |
D、 |
 铁、铜和铝是人类生活中常用的金属.
铁、铜和铝是人类生活中常用的金属. “从生活走进化学,从化学走向社会”.请用化学知识回答以下生活中的问题.
“从生活走进化学,从化学走向社会”.请用化学知识回答以下生活中的问题.