题目内容
5. 如图为半透膜淡化海水分离技术示意图.对海水加压,水分子可以通过半透膜形成淡水,而海水中的其它物质不能通过渗透膜.
如图为半透膜淡化海水分离技术示意图.对海水加压,水分子可以通过半透膜形成淡水,而海水中的其它物质不能通过渗透膜.(1)采用此分离技术所得到的淡水的硬度低(选填“高”或“低”).
(2)对所得淡水进行“矿化”处理来可提高饮用水品质.用CO2酸化的淡水浸泡石灰石使其部分“转化为可溶的碳酸氢钙,达到“矿化”的目的.“转化”过程的化学反应方程式为CO2+H2O+CaCO3═Ca(HCO3)2.
分析 根据海水淡化的方法以及化学反应方程式进行分析.
解答 解:(1)半透膜淡化海水,溶质不能通过淡化膜,所以所得到的淡水的硬度会变低.
(2)化学方程式为CO2+H2O+CaCO3═Ca(HCO3)2.
故答案为:(1)低(2)CO2+H2O+CaCO3═Ca(HCO3)2.
点评 本题主要考查了溶液、溶质,以及化学方程式.

练习册系列答案
相关题目
16. 根据给出的KNO3和NaCl两种物质的溶解度表及溶解度曲线,回答问题.
根据给出的KNO3和NaCl两种物质的溶解度表及溶解度曲线,回答问题.
(1)在0℃时,NaCl的溶解度为35.7g;
(2)观察曲线可知,从海水中提取氯化钠,通常采用的方法是蒸发结晶;
(3)在20℃时将20gKNO3放入100g水中,若保持温度不变,再加入KNO311.6g即可将其变成恰好饱和的溶液;
(4)若KNO3中混有少量的NaCl,可先将混合物溶于水配成高温下的饱和溶液,然后再采用降温结晶的方法就可以提纯KNO3.
 根据给出的KNO3和NaCl两种物质的溶解度表及溶解度曲线,回答问题.
根据给出的KNO3和NaCl两种物质的溶解度表及溶解度曲线,回答问题.| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解 度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
(2)观察曲线可知,从海水中提取氯化钠,通常采用的方法是蒸发结晶;
(3)在20℃时将20gKNO3放入100g水中,若保持温度不变,再加入KNO311.6g即可将其变成恰好饱和的溶液;
(4)若KNO3中混有少量的NaCl,可先将混合物溶于水配成高温下的饱和溶液,然后再采用降温结晶的方法就可以提纯KNO3.
13.下列实验设计错误的是( )
| A. | 用电解水测定水的组成 | B. | 用碘酒检验淀粉 | ||
| C. | 用肥皂水区分硬水和软水 | D. | 用湿润的pH试纸测试稀盐酸的pH |
20.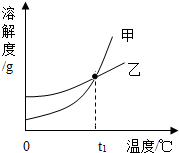 KCl和KNO3的溶解度表及溶解度曲线如图所示,下列说法不正确的是 ( )
KCl和KNO3的溶解度表及溶解度曲线如图所示,下列说法不正确的是 ( )
 KCl和KNO3的溶解度表及溶解度曲线如图所示,下列说法不正确的是 ( )
KCl和KNO3的溶解度表及溶解度曲线如图所示,下列说法不正确的是 ( )| 温度/℃ | 20 | 30 | 40 | 50 | |
| 溶解度S/g | KCl | 34.0 | 37.0 | 40.0 | 42.6 |
| KNO3 | 31.6 | 45.8 | 63.9 | 85.5 | |
| A. | 甲表示KCl溶解度曲线 | |
| B. | 温度t1应在20℃~30℃之间 | |
| C. | 40℃时,5gKCl加入10g水中,可得到33.3%的溶液 | |
| D. | 50℃时,30g KNO3加入50g水,充分溶解,再降温到30℃,有晶体析出 |
17.在“宏观-微观-符号”之间建立联系,是学习化学的一种重要思维方式.如图是元素周期表中部分元素的原子结构示意图,根据所学知识回答下列问题.

(1)如图四元素中,属于非金属元素的是Si(填元素符号).
(2)2个镁离子的符号为2Mg2+;,硅的氧化物的化学式为SiO2.
(3)相对原子质量与 原子真实质量之间存在紧密的关系(见下表),根据下表判断6.02×1023个钠原子的质量H2O为23g.请归纳下表中的规律:6.02×1023个某原子的质量,在数值上等于该原子的相对原子质量.

(1)如图四元素中,属于非金属元素的是Si(填元素符号).
(2)2个镁离子的符号为2Mg2+;,硅的氧化物的化学式为SiO2.
(3)相对原子质量与 原子真实质量之间存在紧密的关系(见下表),根据下表判断6.02×1023个钠原子的质量H2O为23g.请归纳下表中的规律:6.02×1023个某原子的质量,在数值上等于该原子的相对原子质量.
| 碳 | 氧 | 钠 | |
| 相对原子质量 | 12 | 16 | 23 |
| 6.02×1023个原子的质量 | 12g | 16g |
14.化学实验是科学探究的重要学习方式.如图实验操作正确的是( )
| A. |  倾倒液体 | B. |  蒸发食盐水 | C. |  稀释浓硫酸 稀释浓硫酸 | D. |  闻气体气味 |
3.下列物质常用于改良酸性土壤的是( )
| A. | 食盐 | B. | 烧碱 | C. | 大理石 | D. | 熟石灰 |
 如图所示为A、B、C三种固体物质(不含结晶水)的溶解度曲线.下列有关说法正确的是B
如图所示为A、B、C三种固体物质(不含结晶水)的溶解度曲线.下列有关说法正确的是B