题目内容
17. 用“侯氏联合制碱法”制取的纯碱中常含有少量的氯化钠(NaCl).化学实验小组为测定某厂生产的纯碱中碳酸钠的含量,称取12.0g样品进行实验,反应生成的C02气体的质量与滴加的盐酸的质量关系如图所示.试计算:
用“侯氏联合制碱法”制取的纯碱中常含有少量的氯化钠(NaCl).化学实验小组为测定某厂生产的纯碱中碳酸钠的含量,称取12.0g样品进行实验,反应生成的C02气体的质量与滴加的盐酸的质量关系如图所示.试计算:(1)生成的二氧化碳气体的质量4.4g
(2)该纯碱样品中Na2C03质量.
(3)滴入盐酸到不再产生气体时所得溶液中溶质质量分数.
分析 (1)样品中只有碳酸钠可与稀盐酸反应放出二氧化碳,根据图示可知二氧化碳气体的质量;
(2)根据反应的化学方程式,由生成二氧化碳气体的质量计算出样品中碳酸钠的质量;
(3)同样依据二氧化碳可求出生成氯化钠的质量,依据碳酸钠的质量可求出原混合物中氯化钠的质量,据此可计算所得溶液的溶质质量分数.
解答 解:
(1)根据图示可知二氧化碳气体的质量为4.4 g
设:样品中碳酸钠的质量为x,生成的氯化钠质量是y
Na2CO3+2HCl═2NaCl+CO2↑+H2O
106 117 44
x y 4.4g
$\frac{106}{x}=\frac{117}{y}=\frac{44}{4.4g}$
x=10.6g
y=11.7g
原混合物中氯化钠的质量是12g-10.6g=1.4g,由图象可知反应后溶液的质量是12g+57.9g-4.4g=65.5g,
则反应后所得所得溶液中NaCl的质量分数=$\frac{11.7g+1.4g}{65.5g}×$100%≈17.2%
答案:
(1)4.4;
(2)该纯碱样品中Na2C03质量为10.6g;
(3)滴入盐酸到不再产生气体时所得溶液中溶质质量分数为17.2%
点评 对变化的曲线进行分析时,曲线的折点意味着往往是恰好完全反应,此时总质量与反应前总质量的差即为反应放出气体的质量,以此为突破口分析判断,并结合方程式和溶质的质量分数计算即可

练习册系列答案
相关题目
7.2014年上海虹桥商务区的天然气分布式能源系统实现了冷、热、电三联供能,大大提高了能源的利用率.天然气的主要成分是( )
| A. | CO | B. | H2 | C. | CH4 | D. | CH3CH2OH |
5.化学与生活关系密切,下列说法不正确的是( )
| A. | 大量添加防腐剂对身体无害 | |
| B. | 缺乏维生素C会引起坏血病 | |
| C. | 微量元素摄入不足或过量均不利于人体健康 | |
| D. | 黄曲霉毒素能诱发肝癌,不可以食用霉变的食物 |
2.下列说法正确的是( )
| A. | 在蜡烛熔化、燃烧过程中,只发生化学变化 | |
| B. | 用五色酚酞溶液可以鉴别烧碱溶液和纯碱溶液 | |
| C. | 人体缺钙可能导致骨骼疏松、畸形,易得佝偻病 | |
| D. | 合金、合成纤维、合成橡胶是三大有机合成材料 |
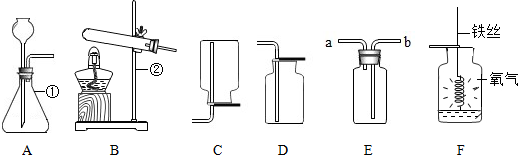
20.用下列装置进行实验,不能达到实验目的是( )
| A. |  证明CO2密度比空气大 | B. |  监控气体流速 | ||
| C. |  证明CO2能溶于水 | D. |  收集氧气 |
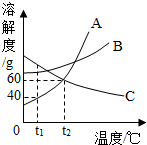 如图是A、B、C三种物质的溶解度曲线.
如图是A、B、C三种物质的溶解度曲线.