题目内容
下列曲线分别与对应的操作过程相对应,其中正确的是

- A.在恒温条件下,将足量的氯化钠饱和溶液蒸发适量的水分
- B.向露置在空气中部分变质的氢氧化钠溶液中加入稀盐酸
- C.向氢氧化钠溶液中不断加水稀释
- D.相同质量且过量的锌粉和铁粉,分别与质量和溶质的质量分数相同的稀盐酸反应
B
A、温度一定,饱和溶液中溶质的质量分数不变,故错误
B、盐酸先和氢氧化钠反应,反应完再和碳酸钠反应,碳酸钠全部反应后二氧化碳的质量将不变,故正确
C、碱中加水,溶液的碱性会减弱,pH减小但不会小于7,故错误
D、由于锌的活泼比铁的强,所以等质量的铁和锌同时分别放入两份溶质质量分数相同的足量稀盐酸锌用的时间短,由公式:m(H2)=(金属的化合价/金属的相对原子质量)×金属的质量,所以锌产生的氢气多,所图象以描述错误
故选B
A、温度一定,饱和溶液中溶质的质量分数不变,故错误
B、盐酸先和氢氧化钠反应,反应完再和碳酸钠反应,碳酸钠全部反应后二氧化碳的质量将不变,故正确
C、碱中加水,溶液的碱性会减弱,pH减小但不会小于7,故错误
D、由于锌的活泼比铁的强,所以等质量的铁和锌同时分别放入两份溶质质量分数相同的足量稀盐酸锌用的时间短,由公式:m(H2)=(金属的化合价/金属的相对原子质量)×金属的质量,所以锌产生的氢气多,所图象以描述错误
故选B

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
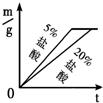
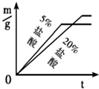
 27、用下列仪器和试剂验证影响金属与盐酸反应速率的因素:烧杯、试管夹、酒精灯、药匙、量筒、天平.锌片、铁片、镁片.5%盐酸、20%盐酸.
27、用下列仪器和试剂验证影响金属与盐酸反应速率的因素:烧杯、试管夹、酒精灯、药匙、量筒、天平.锌片、铁片、镁片.5%盐酸、20%盐酸.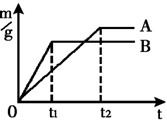
 B.
B. C.
C. D.
D.