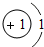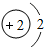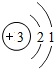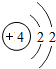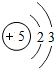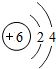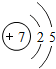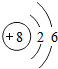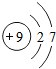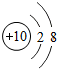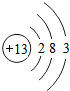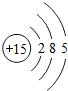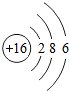题目内容
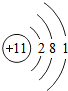
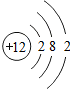
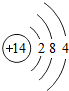
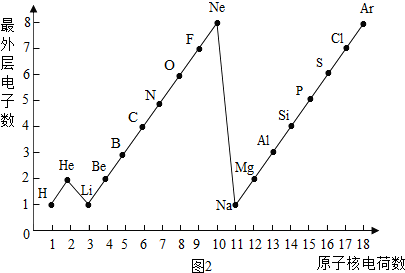
1~18号元素原子最外层电子数与原子序数的关系如图所示,试回答下列问题:

(1)第三周期11~18号元素原子最外层电子数变化的趋势是________.
(2)图中He与Ne、Ar原子最外层电子数不一样,但都处在每周期的结尾处,从原子结构上分析其原因为________________.
(3)原子的核外电子排布,特别是最外层的电子数目,与元素的化学性质都有着密切的关系.

答案:
解析:
解析:
|
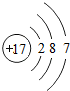
答案:(1)逐渐增加(或从1逐渐增加到8) (2)它们的最外层都达到了相对稳定结构 (3)11 失去 NaCl 解析:分析原子序数与最外层电子数的对应关系,可发现每一周期最外层电子数从1增加到8;He与Ne、Ar原子最外层电子数都达到了相对稳定结构(8个电子,其中He为2个);钠原子的原子核内有11个质子,核外电子数为11,最外层电子数为1,在化学变化中易失去最外层电子形成Na+. |

练习册系列答案
相关题目




 图表是整理数据.发现其中规律的一种重要工具.1一18号元素原子最外层电子数与原子序数的关系如图.试回答:
图表是整理数据.发现其中规律的一种重要工具.1一18号元素原子最外层电子数与原子序数的关系如图.试回答: