题目内容
一、元素周期表是学习和研究化学的重要工具,它的内容十分丰富.如图1是依据元素周期表画出的1~18号元素的原子结构示间图.我对它进行研究:
(1)原子序数为17的元素名称是 ,在化学反应中,该元素的原子容易 (填“得”或“失”)电子;原子序数为13的元素属于 元素(填“金属”或“非金属”)
(2)我发现如下规律:
①原子序数与元素原子核电荷数在数值上相等;
② ;
③ ;…
二、如图2是1~18号元素原子最外层电子数与原子核电荷数的关系图.试回答:
(1)一个水分子共有 原子核、 个质子.
(2)一个Mg2+核外共有 电子;Cl-的最外层电子数和 原子的最外层电子数相同.
(3)通过对该图的分析,你能发现哪些规律?请写出其中一个:
图1

(1)原子序数为17的元素名称是
(2)我发现如下规律:
①原子序数与元素原子核电荷数在数值上相等;
②
③
二、如图2是1~18号元素原子最外层电子数与原子核电荷数的关系图.试回答:
(1)一个水分子共有
(2)一个Mg2+核外共有
(3)通过对该图的分析,你能发现哪些规律?请写出其中一个:
| 1 | 1H |
2He | ||||||
| 2 | 3Li |
4Be |
5B |
6C |
7N |
8O |
9F |
10Ne |
| 3 | 11Na |
12Mg |
13Al |
14Si |
15P |
16S |
17Cl |
18Ar |

分析:一、(1)质子数决定元素种类,最外层电子数小于4个的易失电子,多天4个易得电子;
(2)根据元素周期表及原子结构示意图分析找出规律.
二、(1)由图中1~18号元素原子最外层电子数与原子核电荷数的关系图可知:氢元素、氧元素的质子数;
(2)一个Mg2+是失去2个电子而带的正电荷,故可知其离子核外电子数;Cl-是得到1个电子而带的负电荷,故可知其离子最外层电子数;
(3)通过对该图的分析,总结归纳规律.
(2)根据元素周期表及原子结构示意图分析找出规律.
二、(1)由图中1~18号元素原子最外层电子数与原子核电荷数的关系图可知:氢元素、氧元素的质子数;
(2)一个Mg2+是失去2个电子而带的正电荷,故可知其离子核外电子数;Cl-是得到1个电子而带的负电荷,故可知其离子最外层电子数;
(3)通过对该图的分析,总结归纳规律.
解答:解:一、(1)质子数决定元素种类,原子序数等于质子数,故原子序数为17的元素为 氯元素,氯原子最外层上有7个电子,在化学反应中,该元素的原子容易 得电子;原子序数为13的元素是铝元素,属于 金属元素
(2)分析元素周期表及原子结构示意图可以发现以下规律:第一周期元素的原子核外只有一个电子层;第二周期元素的原子核外有两个电子层;第三周期元素的原子核外有三个电子层;每一周期元素原子的核外电子层数相同;每一周期元素原子的最外层电子数从左到右逐渐增加;每一列元素原子的最外层电子数相同;最后一列元素原子的最外层电子数都达到稳定结构;最外层电子数小于3的原子一般为金属元素,最外层电子数小于3的原子易失去最外层电子形成阳离子.
二、(1)根据“核内质子数=核外电子数=核电荷数”,由图中1~18号元素原子最外层电子数与原子核电荷数的关系图可知:氢元素、氧元素的质子数分别为:1、8;又因为1个水分子由2个氢原子和1个氧原子构成;故一个水分子共有3个原子核,1×2+8=10个质子;
(2)一个Mg2+是失去2个电子而带的正电荷,故可知其离子核外电子数为:12-2=10个;Cl-是得到1个电子而带的负电荷,故可知其离子最外层电子数为:7+1=8,故与Ar、Ne原子的最外层电子数相同;
(3)通过对该图的分析,总结归纳规律:随着核电荷数的递增,最外层电子数呈周期性变化.
故答案为:
一、(1)氯;得;非金属,(2)第一周期元素的原子核外只有一个电子层;第二周期元素的原子核外有两个电子层;第三周期元素的原子核外有三个电子层;每一周期元素原子的核外电子层数相同;每一周期元素原子的最外层电子数从左到右逐渐增加;每一列元素原子的最外层电子数相同;最后一列元素原子的最外层电子数都达到稳定结构;最外层电子数小于3的原子一般为金属元素,最外层电子数小于3的原子易失去最外层电子形成阳离子.
二、(1)3;10;(2)10;Ne、Ar;(3)随着核电荷数的递增,最外层电子数呈周期性变化.
(2)分析元素周期表及原子结构示意图可以发现以下规律:第一周期元素的原子核外只有一个电子层;第二周期元素的原子核外有两个电子层;第三周期元素的原子核外有三个电子层;每一周期元素原子的核外电子层数相同;每一周期元素原子的最外层电子数从左到右逐渐增加;每一列元素原子的最外层电子数相同;最后一列元素原子的最外层电子数都达到稳定结构;最外层电子数小于3的原子一般为金属元素,最外层电子数小于3的原子易失去最外层电子形成阳离子.
二、(1)根据“核内质子数=核外电子数=核电荷数”,由图中1~18号元素原子最外层电子数与原子核电荷数的关系图可知:氢元素、氧元素的质子数分别为:1、8;又因为1个水分子由2个氢原子和1个氧原子构成;故一个水分子共有3个原子核,1×2+8=10个质子;
(2)一个Mg2+是失去2个电子而带的正电荷,故可知其离子核外电子数为:12-2=10个;Cl-是得到1个电子而带的负电荷,故可知其离子最外层电子数为:7+1=8,故与Ar、Ne原子的最外层电子数相同;
(3)通过对该图的分析,总结归纳规律:随着核电荷数的递增,最外层电子数呈周期性变化.
故答案为:
一、(1)氯;得;非金属,(2)第一周期元素的原子核外只有一个电子层;第二周期元素的原子核外有两个电子层;第三周期元素的原子核外有三个电子层;每一周期元素原子的核外电子层数相同;每一周期元素原子的最外层电子数从左到右逐渐增加;每一列元素原子的最外层电子数相同;最后一列元素原子的最外层电子数都达到稳定结构;最外层电子数小于3的原子一般为金属元素,最外层电子数小于3的原子易失去最外层电子形成阳离子.
二、(1)3;10;(2)10;Ne、Ar;(3)随着核电荷数的递增,最外层电子数呈周期性变化.
点评:了解原子的定义和构成,了解核外电子在化学反应中的作用.会根据图表分析规律.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
一、元素周期表是学习和研究化学的重要工具,它的内容十分丰富.如图1是依据元素周期表画出的1~18号元素的原子结构示间图.我对它进行研究:
(1)原子序数为17的元素名称是______,在化学反应中,该元素的原子容易______(填“得”或“失”)电子;原子序数为13的元素属于______元素(填“金属”或“非金属”)
(2)我发现如下规律:
①原子序数与元素原子核电荷数在数值上相等;
②______;
③______;…
二、如图2是1~18号元素原子最外层电子数与原子核电荷数的关系图.试回答:
(1)一个水分子共有______原子核、______个质子.
(2)一个Mg2+核外共有______电子;Cl-的最外层电子数和______原子的最外层电子数相同.
(3)通过对该图的分析,你能发现哪些规律?请写出其中一个:______
| 1 | 1H | 2He | ||||||
| 2 | 3Li | 4Be | 5B | 6C | 7N | 8O | 9F | 10Ne |
| 3 | 11Na | 12Mg | 13Al | 14Si | 15P | 16S | 17Cl | 18Ar |

 元素周期表是学习化学的重要工具.如图是元素周期表中的一格,从中获取的信息不正确的是( )
元素周期表是学习化学的重要工具.如图是元素周期表中的一格,从中获取的信息不正确的是( ) 元素周期表是学习化学的重要工具.如图是元素周期表中的一格,从中可知:
元素周期表是学习化学的重要工具.如图是元素周期表中的一格,从中可知: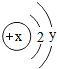 当x-y=5(y≠0)时,该粒子为
当x-y=5(y≠0)时,该粒子为